
【題目】在一定條件下,3molX與3molY在恒容密閉容器中發生反應X(g)+3Y(g)![]() 2Z(g),△H=-Q kJ·molˉ1(Q>0)下列說法正確的是
2Z(g),△H=-Q kJ·molˉ1(Q>0)下列說法正確的是
A. 達到平衡時,反應放出QkJ熱量
B. 反應一段時間后,X與Y的物質的量之比仍為1:1
C. X的體積分數不變,說明反應已達到平衡狀態
D. 達到平衡后,若向平衡體系中充入氦氣,Z的反應速率不變
 學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案
學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案 芒果教輔暑假天地重慶出版社系列答案
芒果教輔暑假天地重慶出版社系列答案科目:高中化學 來源: 題型:
【題目】M、R、X、Y為原子序數依次增大的短周期主族元素,Z是一種過渡元素。M基態原子L層中p軌道電子數是s電子的2倍,R是同周期元素中最活潑的金屬元素,X和M形成的一種化合物是引起酸雨的主要大氣污染物,Z的基態原子4s和3d軌道半充滿。請回答下列問題:
(1)R基態原子的電子排布式是____ ,X和Y中電負性較大的是_____(填元素符號)。
(2)X的氫化物的沸點_____(填“>”或“<”)與其組成相似的M的氫化物,其原因是___________。
(3)X與M形成的XM3分子的空間構型是__________。
(4)M和R所形成的一種離子化合物R2M晶體的晶胞如圖所示,則圖中黑球代表的離子是_________(填離子符號)。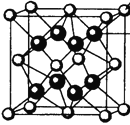
(5)在稀硫酸中,Z的最高價含氧酸的鉀鹽(橙色)氧化M的一種氫化物,Z被還原為+3價,該反應的化學方程式是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計了如圖所示裝置(夾持儀器省略)進行系列實驗,實驗時將藥品A逐滴加入到固體B中,請根據下列實驗回答問題: 
(1)若A為水,B為過氧化鈉,C中盛有酸化過的FeCl2溶液,旋開活塞E后,燒瓶中發生反應的化學方程式為 , C中的現象為 .
(2)利用上述裝置可以設計證明氧化性:KMnO4>Cl2>Br2 , 則A為濃鹽酸,B為高錳酸鉀,C中是試劑為 .
(3)也可設計證明酸性的強弱:H2SO4>H2CO3>H2SiO3 , 若C中裝的是硅酸鈉溶液,則小試管中發生的化學反應方程式為 .
(4)利用上述裝置可以驗證SO2的性質,若A為濃硫酸,B為亞硫酸鈉固體,C中盛有酸性高錳酸鉀溶液,可以驗證SO2的性.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,分別將四塊形狀相同、質量為7g 的鐵塊同時放入下列四種溶液中,產生H2速率最快的是( )
A.150mL 2mol·L-1的鹽酸B.500mL 2mol·L-1的硫酸
C.50mL 6mol·L-1的稀硝酸D.50mL 18.4mol·L-1的硫酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家前不久成功合成了3 mm長的管狀定向碳納米管,長度居世界之首。這種碳纖維具有強度高、剛度(抵抗變形的能力)高、密度小(只有鋼的四分之一)、熔點高、化學穩定性好的特點,因而被稱為“超級纖維”。下列對碳纖維的說法中不正確的是( )
A. 它是制造飛機的理想材料
B. 它的主要組成元素是碳
C. 它的結構與石墨相似
D. 碳纖維復合材料不容易導電
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定容積的密閉容器中進行反應;N2(g)+3H2(g)![]() 2NH3(g)。己知反應過程中某一時刻N2、H2、NH3的濃度分別為0.1mol/L、0.3mol/L、0.2mol/L。當反應達到平衡時,可能存在的數據是
2NH3(g)。己知反應過程中某一時刻N2、H2、NH3的濃度分別為0.1mol/L、0.3mol/L、0.2mol/L。當反應達到平衡時,可能存在的數據是
A. N2為0.2mol/L;H2為0.6mol/L B. N2為0.15mol/L
C. N2、H2均為0.18 mol/L D. NH3為0.4mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 1mol O的質量是16 g/mol B. Na+的摩爾質量是23 g
C. CO2的摩爾質量是44 g/mol D. 氫的摩爾質量是2 g/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在500 ℃時,2SO2(g)+O2(g) ![]() 2SO3(g)正向是放熱反應的體系中,只改變下列條件,請把影響結果填入表中。
2SO3(g)正向是放熱反應的體系中,只改變下列條件,請把影響結果填入表中。
改變條件 | 正反應速率 | 逆反應速率 | 平衡移動情況 |
(1)增大O2的濃度 | |||
(2)增大SO2的濃度 | |||
(3)減小SO3的濃度 | |||
(4)增大壓強 | |||
(5)升高溫度 | |||
(6)加入催化劑 | |||
(7)體積不變充入氖氣 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com