
(16分)肼(N2H4)又稱聯氨,是一種可燃性液體,與氧氣或氮氧化物反應均可生成氮氣和水。氫氣是一種清潔能源,液氫和肼均可用作火箭燃料。
Ⅰ 氫氣的制取與儲存是氫能源利用領域的研究熱點。
已知: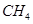 (g)+
(g)+ 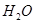 (g)=
(g)=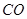 (g)+
(g)+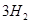 (g)
(g) 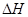 =
+
=
+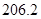

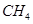 (g)+
(g)+ 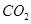 (g)=
(g)=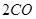 (g)+
(g)+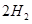 (g)
(g)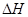 = +
= +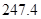

(1)氫氣作為新能源的優點 。(答2點)
(2)以甲烷為原料制取氫氣是工業上常用的制氫方法。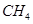 (g)與
(g)與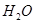 (g)反應生成
(g)反應生成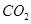 (g)和
(g)和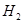 (g)的熱化學方程式為
。
(g)的熱化學方程式為
。
(3)H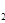 O的熱分解也可得到H
O的熱分解也可得到H ,高溫下水分解體系中主要氣體的體積分數與溫度的關系如圖所示。圖中A、B表示的物質依次是
、 。
,高溫下水分解體系中主要氣體的體積分數與溫度的關系如圖所示。圖中A、B表示的物質依次是
、 。
Ⅱ(4)肼一空氣燃料電池是一種堿性燃料電池,電解質溶液是20%—30%的KOH溶液。該電池放電時,負極的電極反應式是 。
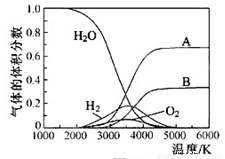
(5)下圖是一個電化學裝置示意圖。用肼一空氣燃料電池做此裝置的電源。
①如果A是鉑電極,B是石墨電極,C是硫酸—硫酸銨,陰極的電極反應式是 。
②利用該裝置可制得少量過氧化氫:在陽極上SO42—被氧化成S2O82—(過二硫酸根離子),S2O82—與H2O反應生成H2O2,S2O82—+2H2O=2SO42—+H2O2+2H+。若要制取2molH2O2,該燃料電池理論上需消耗 molN2H4。
(6)由A、B、C、D四種金屬按下表中裝置進行實驗。
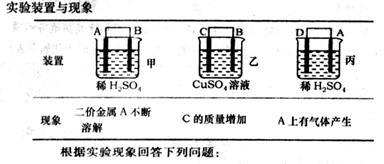
①裝置丙中溶液的P H 。(填“變大”“變小”或“不變”)
②四種金屬活潑性由弱到強的順序是 。
(1) 無污染 , 資源豐富 、熱值高等 ( 各1分)
(2) CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165KJ.mol-1
(3) 氫原子 、氧原子 (各1分) (4) N2H4-4e-+4OH-=N2+4H2O
(5)① 2H++2e-=H2 ↑② 1 (6)① 變大 ② CBAD (每空2分)
【解析】(1)考查氫氣作為能源的特點。根據氫氣的燃燒熱和氫氣的來源可知,氫氣作為新能源的優點生成物是水沒有污染,資源豐富,熱值高等。
(2)考查蓋斯定律的應用,根據反應①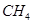 (g)+
(g)+ 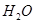 (g)=
(g)=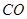 (g)+
(g)+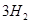 (g)和反應②
(g)和反應②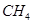 (g)+
(g)+ 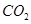 (g)=
(g)=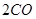 (g)+
(g)+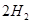 (g)可知,①×2-②即得到CH4(g)+2H2O(g)=CO2(g)+4H2(g),所以反應的反應熱是+
(g)可知,①×2-②即得到CH4(g)+2H2O(g)=CO2(g)+4H2(g),所以反應的反應熱是+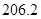
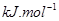 ×2-
×2-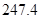
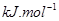 =+165KJ.mol-1,即熱化學方程式為
=+165KJ.mol-1,即熱化學方程式為
CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165KJ.mol-1。
(3)水分解的化學方程式為2H2O 2H2+O2,即氫氣的和氧氣的體積之比是2︰1,所以根據圖像可判斷,A表示的是氫原子,B表示的是氧原子。
2H2+O2,即氫氣的和氧氣的體積之比是2︰1,所以根據圖像可判斷,A表示的是氫原子,B表示的是氧原子。
(4)原電池中負極是失去電子的,所以肼在負極發生氧化反應,電解質是堿性溶液,所以電極反應式為N2H4-4e-+4OH-=N2+4H2O。
(5)電解池中陰極是得到電子的,發生還原反應,B電極和電源的負極相連,所以B是陰極,溶液中中氫離子放電,電極反應式為2H++2e-=H2↑;根據反應式可知要制取2molH2O2,則消耗2mol S2O82—。S2O82—中氧的化合價是-7/4價,SO42—中氧的化合價是-2價,所以生成2mol S2O82—失去的電子是(2-7/4)×8×2=4mol。1mol肼失去4mol電子,根據得失電子守恒可知,消耗肼的物質的量是1mol。
(6)丙是原電池,A極產生氫氣,所以A是正極,D負極,所以丙中pH變大。甲中A不斷溶解,說明A是負極,B是正極。乙中C極質量增加,所以C是正極,B是負極,所以四種金屬活潑性由弱到強的順序是CBAD


 天天練口算系列答案
天天練口算系列答案科目:高中化學 來源: 題型:
 肼(N2H4)又稱聯氨,是一種可燃性液體,與氧氣或氮氧化物反應均可生成氮氣和水,用作火箭燃料.
肼(N2H4)又稱聯氨,是一種可燃性液體,與氧氣或氮氧化物反應均可生成氮氣和水,用作火箭燃料.查看答案和解析>>
科目:高中化學 來源: 題型:
 肼(N2H4)又稱聯氨,廣泛用于火箭推進劑、有機合成及燃料電池,NO2的二聚體N2O4則是火箭中常用的氧化劑,請回答下列問題:
肼(N2H4)又稱聯氨,廣泛用于火箭推進劑、有機合成及燃料電池,NO2的二聚體N2O4則是火箭中常用的氧化劑,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
 肼(N2H4)又稱聯氨,是一種可燃性液體,用作火箭燃料.
肼(N2H4)又稱聯氨,是一種可燃性液體,用作火箭燃料.查看答案和解析>>
科目:高中化學 來源: 題型:
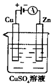 肼(N2H4)又稱聯氨,可用作火箭燃料.肼一空氣燃料電池中的電解質溶液是20%~30%的KOH溶液.該燃料電池可作為如圖裝置中的電源.下列判斷錯誤的是( )
肼(N2H4)又稱聯氨,可用作火箭燃料.肼一空氣燃料電池中的電解質溶液是20%~30%的KOH溶液.該燃料電池可作為如圖裝置中的電源.下列判斷錯誤的是( )查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com