
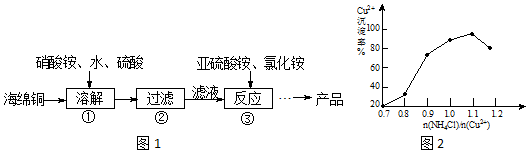
分析 酸性條件下硝酸根離子具有氧化性,可氧化海綿銅(主要成分是Cu和少量CuO)生成硫酸銅,過濾后在濾液中加入亞硫酸銨發生氧化還原反應生成CuCl,發生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的產品CuCl,經硫酸酸洗,水洗后再用乙醇洗滌,烘干得到氯化亞銅,據此分析.
解答 解:酸性條件下硝酸根離子具有氧化性,可氧化海綿銅(主要成分是Cu和少量CuO)生成硫酸銅,過濾后在濾液中加入亞硫酸銨發生氧化還原反應生成CuCl,發生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl經硫酸酸洗,水洗后再用乙醇洗滌,烘干得到氯化亞銅.
(1)溶解溫度應控制在60-70℃,原因是溫度低溶解速度慢,溫度過高銨鹽分解;
故答案為:溫度低溶解速率慢,溫度過高銨鹽分解;
(2)步驟③中銅離子與亞硫酸銨發生氧化還原反應生成CuCl,發生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,當氯化銨用量增加到一定程度后氯化亞銅的沉淀率減少,原因是生成的氯化亞銅又溶解于氯化銨溶液中;
故答案為:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;生成的CuCl又溶解于氯化銨溶液中;
(3)不斷搖動玻璃珠的目的是加速樣品的溶解;
故答案為:加速樣品溶解;
n(Cr2O72-)=0.05mol•L-1×1.6×10-2L=8×10-4mol
6CuCl--------------------------Cr2O72-
6 1
n (CuCl) 8×10-4mol
n (CuCl)=4.8×10-3mol
ω(CuCl)=$\frac{4.8×1{0}^{-3}mol×99.5g/mol}{0.5g}×100%$=95.52%;
答:CuCl純度為95.52%.
點評 本題考查物質的制備實驗,為高頻考點,側重于學生的分析能力、實驗能力的考查,注意把握物質的性質以及反應流程,題目難度中等,注意習題中信息應用.


科目:高中化學 來源: 題型:選擇題
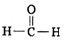 )中含有的共用電子對總數為2NA
)中含有的共用電子對總數為2NA| A. | ①④ | B. | ③④ | C. | ②⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 11.2L | B. | 5.6L | C. | 8.4L | D. | 14L |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 將pH=5的HCl 溶液稀釋1000倍后pH變為8 | |
| B. | 將pH=8的NaOH溶液稀釋1000倍后pH變為6 | |
| C. | 將 pH=2的HCl 溶液加熱蒸發,體積變為原來的$\frac{1}{10}$,pH變為1 | |
| D. | 將pH=3的醋酸溶液稀釋100倍后,pH<5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入肥皂液產生渾濁的水是硬水 | |
| B. | 軟水不一定是純水 | |
| C. | 硬水中的鈣、鎂離子通過加熱煮沸可以完全沉下 | |
| D. | 硬水加入石灰一純堿后生成Mg(OH)2和CaCO3沉淀;利用離子交換劑也可把硬水軟化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸雨是指pH<5.6的雨水 | |
| B. | 二氧化碳大量排放會造成溫室效應 | |
| C. | 白色污染會造成“水華”和“赤潮” | |
| D. | 燃煤中摻入生石灰能有效減少SO2的排放 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
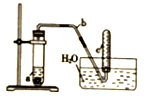 用圖示簡易裝置可以進行某些氮氧化物氣體的制取、收集及性質檢驗.
用圖示簡易裝置可以進行某些氮氧化物氣體的制取、收集及性質檢驗.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H<0、△S>0的反應在溫度低時不能自發進行 | |
| B. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol能自發進行,原因是體系有自發地向混亂度增大的方向轉變的傾向 | |
| C. | 因為焓變和熵變都與反應的自發性有關,因此焓變或熵變均可以單獨作為反應自發性的判據 | |
| D. | 化學反應的限度不可以通過改變條件而改變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com