
【題目】Y是合成香料、醫藥、農藥及染料的重要中間體,可由X在一定條件下合成:

下列說法不正確的是( )
A.Y中有三種官能團
B.由X制取Y的過程中可得到乙醇
C.一定條件下,Y能發生加聚反應和縮聚反應
D.等物質的量的X、Y分別與NaOH 溶液反應,最多消耗NaOH的物質的量之比為3∶2
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】CO2的資源化利用能有效減少CO2的排放,充分利用碳資源。
(1)全球變暖現象很可能是大氣中的溫室氣體(如CO2)聚集造成的。有科學家提出可以將CO2通過管道輸送到海底,這樣可減緩空氣中CO2濃度的增加。下列有關說法正確的是______(填字母)。
A 送到海底越深的地方,CO2溶解得越多,同時CO2可能液化甚至變成干冰
B 把CO2輸送到海底,會使海水酸性增強,有利于海洋生態環境
C 把CO2輸送到海底,這是人類減緩空氣中CO2濃度增加速率的唯一辦法
D 要減緩空氣中CO2濃度的增加,最有效的措施是使用新能源和植樹造林
(2)已知:
①CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) △H=-890 kJ· mol-1
CO2(g)+2H2O(l) △H=-890 kJ· mol-1
②2H2(g)+O2(g)![]() 2H2O(l) △H=-572 kJ· mol-1
2H2O(l) △H=-572 kJ· mol-1
則反應CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) △H=______kJ· mol-1,升高溫度,該反應的v(逆)__________(填“增大”或“減小”)。
CH4(g)+2H2O(l) △H=______kJ· mol-1,升高溫度,該反應的v(逆)__________(填“增大”或“減小”)。
(3)CO2催化加氫合成二甲醚是CO2轉化的-種方法,主要發生下列反應:
反應I:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41.2 kJ· mol-1
CO(g)+H2O(g) △H=+41.2 kJ· mol-1
反應II:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
在一體積為1 L的恒容密閉容器中,充入1 mol CO2與1 mol H2,CO2的平衡轉化率和平衡時CH3OCH3的選擇性隨溫度的變化曲線如圖所示。其中:CH3OCH3的選擇性=![]() ×100%。
×100%。
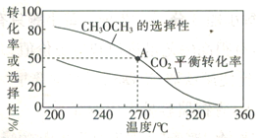
①CH3OCH3的選擇性隨溫度的升高而降低的原因是___________,溫度高于300℃時,CO2的平衡轉化率隨溫度的升高而增大的原因是____________。
②270°C時,測得平衡時CH3OCH3的物質的量為0.1 mol,此時n(H2O)=_________mol,反應I的化學平衡常數K=___________(保留兩位有效數字)。
(4)多晶Cu是目前唯一被實驗證實能高效催化CO2還原為烴類(如C2H4)的金屬。電解裝置中分別以多晶Cu和鉑為電極材料,用陰離子交換膜分隔開陰、陽極室,陰、陽極室的KHCO3溶液的濃度(約0.1 mol·L-1左右)基本保持不變。并向某極室內持續通入CO2,溫度控制在10℃左右。通入CO2的電極為__________(填“陰極”或“陽極”),生成C2H4的電極反應式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)有機物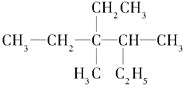 用系統命名法命名:________________________
用系統命名法命名:________________________
(2)寫出4甲基2乙基1戊烯的結構簡式:________________________
(3)某烴的結構簡式是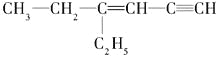 ,分子中飽和碳原子數為_____,可能在同一平面上的碳原子數最多為_________
,分子中飽和碳原子數為_____,可能在同一平面上的碳原子數最多為_________
(4)下列物質中屬于同系物的是_________
①CH3CH2Cl ②CH2===CHCl ③CH3CH2CH2Cl ④CH2ClCH2Cl ⑤CH3CH2CH2CH3⑥CH3CH(CH3)2
A.①② | B.①④ | C.①③ | D.⑤⑥ |
(5)0.1 mol某烷烴燃燒,其燃燒產物全部被堿石灰吸收,堿石灰增39g。該烴的分子式為________;若它的核磁共振氫譜共有3個峰,則該烴可能的結構簡式為________。(寫出其中一種即可)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列解釋事實的方程式不正確的是
A.用鋁冶煉鐵:2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
B.常溫時,0.1mol·L-1氨水的pH=11.1:NH3·H2O ![]() NH
NH![]() +OH-
+OH-
C.“NO2球”浸泡在熱水中,顏色變深:2NO2(g)(紅棕色)![]() N2O4(g)(無色)
N2O4(g)(無色) ![]()
D.用酸化的H2O2溶液從灰化的海帶中提碘:H2O2+2H++2I-=I2+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2010年5月1日上海世博會隆重開幕,受到全世界人們的關注。世博會的環保概念是人們關心的話題,環保材料更為世人矚目,其中聚碳酸酯是用得較多的材料。聚碳酸酯的結構簡式如圖所示,下列說法正確的是( )
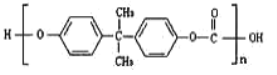
A.它是由一種單體聚合而成的B.它是通過加聚反應得到的產物
C.它是一種純凈物D.它不耐強堿,可發生水解反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乳酸乙酯(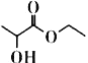 )是一種食用香料,常用于調制果香型、乳酸型食用和酒用精。乳酸乙酯的同分異構體M有如下性質:0.1mol M分別與足量的金屬鈉和碳酸氫鈉反應,產生的氣體在相同狀況下的體積相同,則M的結構最多有 (不考慮空間異構) ( )
)是一種食用香料,常用于調制果香型、乳酸型食用和酒用精。乳酸乙酯的同分異構體M有如下性質:0.1mol M分別與足量的金屬鈉和碳酸氫鈉反應,產生的氣體在相同狀況下的體積相同,則M的結構最多有 (不考慮空間異構) ( )
A.8種B.10種C.12種D.14種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溫度為T1時,將氣體X和氣體Y各1.6mol充入10L恒容密閉容器中,發生反應X(g)+Y(g)![]() 2Z(g),一段時間后達到平衡。反應過程中測定的數據如表:下列說法正確的是
2Z(g),一段時間后達到平衡。反應過程中測定的數據如表:下列說法正確的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反應0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1時,反應的平衡常數K1=1.2
C. 其他條件不變,9 min后,向容器中再充入1.6 molX,平衡向正反應方向移動,再次達到平衡時X的濃度減小,Y的轉化率增大
D. 其他條件不變,降溫到T2達到平衡時,平衡常數K2=4,則此反應的△H<0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把NH4Cl晶體溶入水中,得到飽和NH4Cl溶液。
(1)若在該溶液中加入鎂條,觀察到有氣泡產生,點燃有爆鳴聲,此氣體是___,產生該氣體的原因是___(用離子方程式表示)。
(2)微熱后,能放出有刺激性氣味的氣體,它能使濕潤的紅色石蕊試紙變藍,該氣體是___,產生該氣體的原因是___。
(3)總反應的離子方程式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磁性材料產業是21世紀各國競相發展的高科技支柱產業之一,磁性材料廣泛用于電子信息、軍事技術等領域。碳酸錳主要用于制備軟磁鐵氧體,工業上用氯化銨焙燒菱錳礦粉制備高純度碳酸錳的工藝流程如下:
已知:①菱錳礦粉的主要成分是MnCO3,還含少量Fe、Al、Ca、Mg等元素。
②相關金屬Mn+離子c(Mn+) ═ 0.1 mol L -1形成M(OH) n沉淀的pH范圍如下:
金屬離子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
開始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
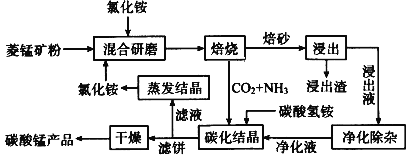
回答下列問題:
(1)“焙燒”時發生的主要反應的化學方程式為_____________________________。
(2)浸出液“凈化除雜”過程如下:①加入MnO2將Fe2+氧化為Fe3+;②調節溶液pH,將Al3+、Fe3+變為沉淀除去,調節pH范圍為__________③加入NH4F將___________離子(填離子符號)沉淀除去。
(3)碳化結晶時,反應的離子方程式為_____________________________________。
(4)碳化結晶過程中不能用碳酸銨溶液代替碳酸氫銨溶液可能的原因是________________。流程中能循環利用的物質除了氯化銨之外還有____________。
(5)測定碳酸錳產品的純度。
稱取0.5000 g碳酸錳產品于錐形瓶中,加25.00 mL磷酸,加熱,碳酸錳全部轉化為[Mn(PO4)2]3-,冷卻至室溫。加水稀釋至100 mL,滴加2~3滴指示劑,然后用濃度為0.2000 mol·L-1的硫酸亞鐵銨[(NH4)2Fe(SO4)2]標準溶液滴定(反應為:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重復操作3次,記錄數據如下表:
滴定次數 | 0.2000 mol·L-1的硫酸亞鐵銨標準溶液讀數(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
則產品的純度=__________,若滴定終點時發現滴定管尖嘴處產生了氣泡,則測得的碳酸錳粗產品的純度_______(填“偏高”“ 偏低”或“無影響”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com