
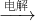 A+B+C
A+B+C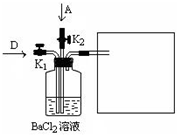 ______.
______. A+B+C,且A為刺激性氣體,C為無色無味氣體,應為氯堿工業(yè)的重要反應,甲為NaCl溶液,A為Cl2,B為NaOH,C為H2;
A+B+C,且A為刺激性氣體,C為無色無味氣體,應為氯堿工業(yè)的重要反應,甲為NaCl溶液,A為Cl2,B為NaOH,C為H2; ,故答案為:
,故答案為: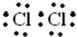 ;
;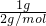 =0.5mol,在Cl2中燃燒時放出92.3kJ的熱量,則1molH2反應放出的熱量為184.6kJ,反應的熱化學方程式為H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol,
=0.5mol,在Cl2中燃燒時放出92.3kJ的熱量,則1molH2反應放出的熱量為184.6kJ,反應的熱化學方程式為H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol,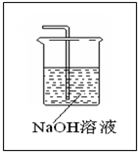 ,故答案為:Cl2 +SO2+BaCl2+2H2O=BaSO4↓+4HCl;
,故答案為:Cl2 +SO2+BaCl2+2H2O=BaSO4↓+4HCl;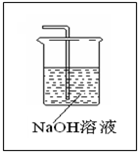 ;
;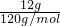 =0.1mol,反應過程中轉移1.5mol電子,則1molFeS2轉移15mol電子,則Fe被氧化為+3價,S被氧化為+6價,反應的離子方程式為FeS2 +14H++15NO3-=Fe3++2SO42-+15 NO2↑+7H2O,
=0.1mol,反應過程中轉移1.5mol電子,則1molFeS2轉移15mol電子,則Fe被氧化為+3價,S被氧化為+6價,反應的離子方程式為FeS2 +14H++15NO3-=Fe3++2SO42-+15 NO2↑+7H2O, A+B+C,且A為刺激性氣體,C為無色無味氣體,應為氯堿工業(yè)的重要反應,甲為NaCl溶液,A為Cl2,B為NaOH,C為H2;
A+B+C,且A為刺激性氣體,C為無色無味氣體,應為氯堿工業(yè)的重要反應,甲為NaCl溶液,A為Cl2,B為NaOH,C為H2;

科目:高中化學 來源: 題型:
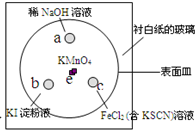 (2011?崇明縣一模)如圖,化學實驗的微型化可有效減少污染,實現化學實驗的綠色要求.某學生在一塊襯白紙的玻璃片的不同位置分別加一滴含酚酞的NaOH溶液(a)、濃度為0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e處放置少量KMnO4晶體,向KMnO4晶體上滴加幾滴濃鹽酸后立即用表面皿蓋好,形成一個氣室.
(2011?崇明縣一模)如圖,化學實驗的微型化可有效減少污染,實現化學實驗的綠色要求.某學生在一塊襯白紙的玻璃片的不同位置分別加一滴含酚酞的NaOH溶液(a)、濃度為0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e處放置少量KMnO4晶體,向KMnO4晶體上滴加幾滴濃鹽酸后立即用表面皿蓋好,形成一個氣室.查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 選項 | 已知 | 類比推理 |
| A | Na與O2共熱生成Na2O2 | H2與O2共熱生成H2O2 |
| B | S、Se屬于VIA族元素 | Se的氧化物類似S有SeO2、SeO3 |
| C | 常溫下,濃硝酸使鐵鈍化 | 濃硝酸與銅不反應 |
| D | NaOH溶液能溶解Al(OH)3 | 過量NH3?H2O緩慢溶解Al(OH)3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com