
【題目】堿式碳酸銅和氯氣都是用途廣泛的化工原料。
(1)工業上可用酸性刻蝕廢液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl)制備堿式碳酸銅,其制備過程如下: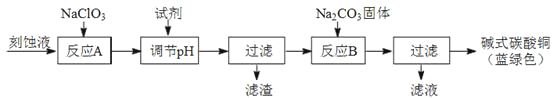
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物質 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
開始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸鈉的作用是;
②反應A后調節溶液的pH范圍應為。
③第一次過濾得到的產品洗滌時,如何判斷已經洗凈?。
④造成藍綠色產品中混有CuO雜質的原因是。
(2)某學習小組在實驗室中利用下圖所示裝置制取氯氣并探究其性質。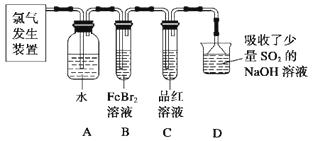
①實驗室用二氧化錳和濃鹽酸加熱制取氯氣,所用儀器需要檢漏有。
②若C中品紅溶液褪色,能否證明氯氣與水反應的產物有漂白性,說明原因。此時B裝置中發生反應的離子方程式是。
③寫出A溶液中具有強氧化性微粒的化學式。若向A溶液中加入NaHCO3粉末,會觀察到的現象是。
【答案】
(1)將Fe2+氧化成Fe3+并最終除去。;3.2-4.2。;取最后一次洗滌液,加入硝酸銀、稀硝酸,無沉淀生成則表明已洗滌干凈。;反應B的溫度過高。
(2)分液漏斗;不能證明,因為Cl2也有氧化性,此實驗無法確定是Cl2還是HClO漂白;2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2;有無色氣體產生
【解析】(1)該化學工藝流程目的是酸性廢液制備堿式碳酸銅,必須除去廢液中Fe3+、Fe2+ , 結合題所給的數據,需將Fe2+氧化為Fe3+,才能與Cu2+分離開。刻蝕廢液加入NaClO3 , 經的反應A將Fe2+氧化為Fe3+ , 調節pH范圍是3.2-4.2,Fe3+轉化為氫氧化鐵沉淀經過濾,濾液中加入碳酸鈉經反應B生成堿式碳酸銅,過濾得產品。判斷洗凈的方法是,取最后一次洗滌液,加入硝酸銀、稀硝酸,無沉淀生成則表明已洗滌干凈。造成藍綠色產品中混有CuO雜質的原因是,反應B的溫度過高。(2)①實驗室用二氧化錳和濃鹽酸加熱制取氯氣為固液加熱制氣體的裝置,所用儀器需要檢漏的有分液漏斗;②若C中品紅溶液褪色,不能證明氯氣與水反應的產物有漂白性,原因是因為Cl2也有氧化性,此實驗無法確定是Cl2還是HClO漂白;C中品紅溶液褪色,說明裝置B中氯氣已過量,此時B裝置中亞鐵離子和溴離子均被氧化,離子方程式是2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2。②氯氣與水反應生成鹽酸和次氯酸,該反應為可逆反應,次氯酸為弱酸,則A溶液中具有強氧化性微粒的化學式是Cl2、HClO、ClO-;若向A溶液中加入NaHCO3粉末,鹽酸和碳酸氫鈉反應生成氯化鈉、水和二氧化碳,會觀察到的現象是有無色氣體產生。


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:
【題目】某化學學習小組設計了如下從海帶灼燒后的海帶灰中提取碘單質的流程: 
(1)溶解海帶灰時要加熱煮沸2~3min的目的是 , 操作a的名稱為 .
(2)向酸化的溶液I中加入H2O2的目的為 .
(3)已知I2與40%的NaOH溶液反應生成的氧化產物和還原產物的物質的量之比為1:5,寫出對應的化學方程式 .
(4)最后過濾得到的I2需要進行洗滌和干燥,下列洗滌劑中最應該選用的是(填選項字母).
A.水
B.乙醇
C.冷水
D.乙醇的水溶液
(5)用Na2S2O3的標準溶液測定產品的純度,發生反應:I2+2Na2S2O3=Na2S4O6+2NaI.取5.0g產品,配制成100mL溶液.取10.00mL溶液,以淀粉溶液為指示劑,用濃度為0,.050molL﹣1Na2S2O3的標準溶液進行滴定,相關數據記錄如下表所示.
編號 | 1 | 2 | 3 |
溶液的體積/mL | 10.00 | 10.00 | 10.00 |
消耗Na2S2O3標準溶液的體積/mL | 19.95 | 17.10 | 20.05 |
滴定時,達到滴定終點的現象是 , 碘單質在產品中的質量分數是(用百分數表示,且保留1位小數).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組為測定一定質量的某銅鋁混合物中銅的質量分數,設計了如下實驗方案:
方案Ⅰ:銅鋁混合物 ![]() 測定生成氣體的體積
測定生成氣體的體積
方案Ⅱ:銅鋁混合物 ![]() 測定剩余固體的質量
測定剩余固體的質量
下列有關判斷中不正確的是( )
A.溶液A和B均可以是鹽酸或NaOH溶液
B.若溶液B選用濃硝酸,則測得銅的質量分數偏小
C.溶液A和B均可選用稀硝酸
D.實驗室中方案Ⅱ更便于實施
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A.糖類化合物都能發生水解
B.氨基酸、淀粉均屬于高分子化合物
C.植物油的主要成分是高級脂肪酸
D.蔗糖、麥芽糖的分子式都是C12H22O11,二者互為同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 通過化學變化可以實現16O與18O之間的轉化
B. 因為H2O的沸點高于H2S,所以O原子得電子能力大于S原子
C. 某化合物熔融狀態下能導電,該化合物中一定有離子鍵
D. 16O2與18O2互為同素異形體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列變化中,由加成反應引起的是
A.乙烯通入酸性高錳酸鉀溶液中,高錳酸鉀溶液褪色
B.由電石制乙炔
C.一定條件下,苯滴入濃硝酸和濃硫酸的混合液中,有油狀物生成
D.苯在一定溫度、壓強和催化劑的作用下和氫氣反應,生成環己烷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述不正確的是( )
A. 用新制氫氧化銅試劑檢驗某病人是否患糖尿病
B. 在植物油中滴入溴水,溴水褪色
C. 在雞蛋白溶液中滴入濃HNO3,微熱會產生黃色物質
D. 酶不屬于蛋白質
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com