
 如圖是一種以某燃料電池為電源,對氯化鈉溶液進行電解的裝置.該燃料電池的電解質是摻雜氧化釔(Y2O3)的氧化鋯(ZrO2),在熔融狀態下能傳導O2-.
如圖是一種以某燃料電池為電源,對氯化鈉溶液進行電解的裝置.該燃料電池的電解質是摻雜氧化釔(Y2O3)的氧化鋯(ZrO2),在熔融狀態下能傳導O2-.| 0.52mol |
| 2 |
| 0.52mol |
| 2 |


科目:高中化學 來源: 題型:閱讀理解
| n |
| 3 |
| n |
| 3 |
| V/s | 0 | 50 | 100 |
| c(N2O3)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
利用N2和H2可以實現NH3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產。請回答下列問題:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mo
若有17g氨氣經催化氧化完全生成一氧化氮氣體和水蒸氣所放出的熱量為 。
(2)某科研小組研究:在其他條件不變的情況下,改變起始物氫氣的物質的量對N2(g)+3H2(g) ![]()
2NH3(g)反應的影響。實驗結果如圖所示:(圖中T表示溫度,n表示物質的量)

①圖像中T2和T1的關系是:T2 T2(填“高于”“低于”“等于”“無法確定”)
②比較在a、b、c三點所處的平衡狀態中,反應物N2的轉化率最高的是 (填字母)。
③在起始體系中加入N2的物質的量為 mol時,反應后氨的百分含量最大。若容器容積為H,n=3mol反應達到平衡時H2的轉化率為60%,則此條件下(T2),反應的平衡常數K= 。
(3)N2O3是一種新型硝化劑,其性質和制備受到人們的關注。
①一定溫度下,在恒容密閉容器中N2O3可發生下列反應:
2N2O3![]() 4NO2(g)+O2 △H>0下表為反應在T1溫度下的部分實驗數據
4NO2(g)+O2 △H>0下表為反應在T1溫度下的部分實驗數據
| Vs | 0 | 500 | 1000 |
| c(N2O3)/mol·L-1 | 5.00 | 3.52 | 2.48 |
則500s內NO2的平均生成速率為 .
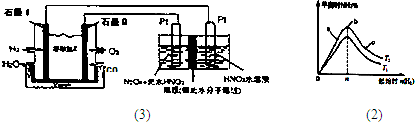
②現以H2、O2、熔融鹽Na2CO3組成的燃料電池,采用電解法制備N2O3,裝置如圖所示,其中Y為CO2。

寫出石墨I電極上發生反應的電極反應式 。
在電解池中生成N2O3的電極反應式為 。
查看答案和解析>>
科目:高中化學 來源:2010屆江蘇啟東中學高三考前輔導訓練化學試題 題型:填空題
利用N2和H2可以實現NH3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產。請回答下列問題:
(1)已知:N2(g) + O2(g) === 2NO(g) △H= +180.5kJ/mol
N2(g) + 3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g) + O2(g) ="==" 2H2O(g) △H=-483.6kJ/mol
若有17 g氨氣經催化氧化完全生成一氧化氮氣體和水蒸氣所放出的熱量為______。
(2)某科研小組研究:在其他條件不變的情況下,改變起始物氫氣的物質的量對N2(g)+3H2(g) 2NH3(g)反應的影響。
2NH3(g)反應的影響。
實驗結果如圖所示:(圖中T表示溫度,n表示物質的量)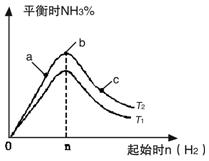
①圖像中T2和T1的關系是:T2 ______T1(填“高于”、“低于”、
“等于”或“無法確定”)。
②比較在a、b、c三點所處的平衡狀態中,反應物N2 的轉化率最 高的是______(填字母)。
③在起始體系中加入N2的物質的量為________mol時,反應后氨的百分含量最大;若容器容積為1L,n=3mol反應達到平衡時H2的轉化率為60%,則此條件下(T2),反應的平衡常數K=________________________。
(3)N2O5是一種新型硝化劑,其性質和制備受到人們的關注。
①一定溫度下,在恒容密閉容器中N2O5可發生下列反應:
2N2O5(g)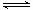 4NO2(g)+O2(g) ΔH>0下表為反應在T1溫度下的部分實驗數據
4NO2(g)+O2(g) ΔH>0下表為反應在T1溫度下的部分實驗數據
則500s內NO2的平均生成速率為 。
②現以H2、O2、熔融鹽W#W$W%.K**S*&5^UNa2CO3組成的燃料電池,采用電解法制備N2O5,
裝置如圖所示,其中Y為CO2。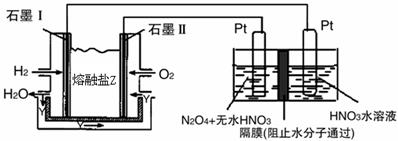
寫出石墨I電極上發生反應的電極反應式 。
在電解池中生成N2O5的電極反應式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com