
【題目】常溫下將NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的離子濃度與溶液pH的變化關系如圖所示。下列敘述正確的是

A. Kal(H2X)的數量級為10-7
B. 曲線N表示lg 與pH的變化關系
與pH的變化關系
C. NaHX溶液中:c(H+)<c(OH-)
D. 當混合溶液呈中性時,c(Na+)>c(X2-)>c(HX-)> c(H+)=c(OH-)
【答案】D
【解析】A、發生的反應先后順序是H2X+NaOH=NaHX+H2O、NaHX+NaOH=Na2X+H2O,開始隨著反應的進行,HX-物質的量增多,某一時刻當HX-的物質的量大于H2X,其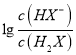 數值先大于0,根據圖像,因此M為
數值先大于0,根據圖像,因此M為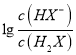 ,N為
,N為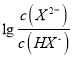 ,H2X的第一電離:H2X
,H2X的第一電離:H2X![]() HX-+H+,Ka1=
HX-+H+,Ka1=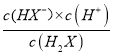 ,根據具圖像,每一小格代表0.2,即找出(5 0.6)點,代入數值,解得Ka1=10-5,故A錯誤;B、根據選項A的分析,故B錯誤;C、當H2X全部轉化成NaHX,繼續加入NaOH溶液,發生NaHX+NaOH=Na2X+H2O,隨著氫氧化鈉量的增加,X2-增加,當X2-的物質的量大于HX-時,
,根據具圖像,每一小格代表0.2,即找出(5 0.6)點,代入數值,解得Ka1=10-5,故A錯誤;B、根據選項A的分析,故B錯誤;C、當H2X全部轉化成NaHX,繼續加入NaOH溶液,發生NaHX+NaOH=Na2X+H2O,隨著氫氧化鈉量的增加,X2-增加,當X2-的物質的量大于HX-時, 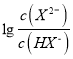 >0,根據圖像,此時的溶液顯酸性,說明NaHX的溶液中HX-的電離程度大于其水解,溶液顯酸性,即c(H+)>c(OH-),故C錯誤;D、NaHX的水溶液顯酸性,因此溶液顯中性時,溶質為NaHX和Na2X,HX-的電離平衡常數Ka2=
>0,根據圖像,此時的溶液顯酸性,說明NaHX的溶液中HX-的電離程度大于其水解,溶液顯酸性,即c(H+)>c(OH-),故C錯誤;D、NaHX的水溶液顯酸性,因此溶液顯中性時,溶質為NaHX和Na2X,HX-的電離平衡常數Ka2=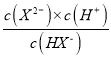 =10-5×10-0.4=10-5.4,X2-的水解平衡常數=
=10-5×10-0.4=10-5.4,X2-的水解平衡常數=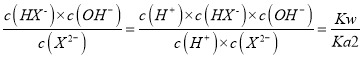 =10-8.6<10-5.4,說明HX-的電離程度大于X2-水解程度,NaHX和Na2X濃度相等時,溶液顯酸性,因此Na2X的濃度應大于NaHX,溶液顯中性,即離子濃度大小順序是c(Na+)>c(X2-)>c(HX-)> c(H+)=c(OH-),故D正確。
=10-8.6<10-5.4,說明HX-的電離程度大于X2-水解程度,NaHX和Na2X濃度相等時,溶液顯酸性,因此Na2X的濃度應大于NaHX,溶液顯中性,即離子濃度大小順序是c(Na+)>c(X2-)>c(HX-)> c(H+)=c(OH-),故D正確。


科目:高中化學 來源: 題型:
【題目】下列敘述錯誤的是( )
A.10mL質量分數為98%的H2SO4 , 用10mL水稀釋后,H2SO4的質量分數大于49%
B.配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶
C.在標況下,將22.4L氨氣溶于1L水中,得到1mol/L的氨水
D.同溫同壓下,20mLCH4和60mLO2所含的原子數之比為5:6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應既是氧化還原反應,又是吸熱反應的是
A. 實驗室制備氫氣 B. 灼熱的碳與水的反應
C. Ba(OH)2·8H2O與NH4Cl的反應 D. 鋁粉與氧化鐵粉末反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實能說明NH3·H2O一定是弱電解質的是
①常溫下,NH3·H2O溶液能使酚酞變紅; ②用NH3·H2O溶液做導電性實驗,燈泡很暗;
③常溫下,0.1mol / L氯化銨溶液的pH約為5
④常溫下,體積相同且pH相同的NH3·H2O溶液和NaOH溶液,與相同濃度的HCl溶液中和時,消耗HCl溶液的體積:前者>后者
A.①②③④ B.②③④ C.③④ D.②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列選項中能表示阿伏伽德羅常數數值的是( )
A.1mol H+含有的電子數
B.標準狀況下,22.4L酒精所含的分子數
C.1.6 g CH4 含有的質子數
D.1L 1mol/L的硫酸鈉溶液所含的Na+ 數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于苯的說法中,正確的是:
A. 苯分子為平面正六邊形結構,6個碳原子之間的鍵完全相同
B. 從苯的結構看,分子中含有單、雙鍵,所以能使酸性高錳酸鉀溶液和溴的四氯化碳溶液因反應而褪色
C. 在催化劑存在下,苯能與溴水發生取代反應,生成溴苯
D. 苯是一種密度比水大,不溶于水的有特殊氣味的無色液體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丙烯酸(CH2 = CH — COOH)的性質可能有( )
① 加成反應 ② 取代反應 ③ 酯化反應 ④ 中和反應 ⑤ 氧化反應
A. 只有①③ B. 只有①③④ C. 只有①③④⑤ D. ①②③④⑤
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com