
下列離子方程式或化學方程式正確的是
A.粗硅的制取:SiO2+C  Si+CO2↑
Si+CO2↑
B.赤鐵礦與稀鹽酸的反應:Fe3O4+8H+ = Fe2++2Fe3++4H2O
C.向Ba(OH)2溶液加入過量NaHCO3溶液:2HCO3— + Ba2+ + 2OH— = BaCO3↓+2H2O +CO32-
D.向燒堿溶液中通入氯氣可制取漂白粉:Cl2+2NaOH=NaCl+NaClO+H2O
科目:高中化學 來源:2017屆四川省高三上學期10月月考化學試卷(解析版) 題型:選擇題
X、Y、Z、W是短周期主族元素,X原子最外層電子數是次外層的兩倍,Y元素在地殼中的含量最多,Z元素的金屬性最強,W原子的核外電子數是X原子與Z原子的核外電子數之和。下列敘述正確的是
A. X、Y、Z形成的化合物不止一種
B. X的氫化物比Y的氫化物穩定
C. 原子半徑的大小順序:r(W)>r(Z)>r(Y)>r(X)
D. Y與Z或W形成的化合物中只含離子鍵
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長沙市高三上月考二化學試卷(解析版) 題型:實驗題
硫酸亞錫(SnSO4)是一種重要的能溶于水的硫酸鹽,廣泛應用于鍍錫工業。某研究小組設計SnSO4制備路線如下:
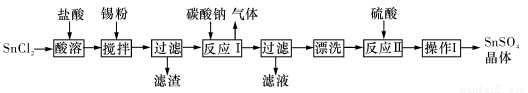
查閱資料:
I.酸性條件下,錫在水溶液中有Sn2+、Sn4+兩種主要存在形式,Sn2+易被氧化。
Ⅱ.SnC12易水解生成堿式氯化亞錫[Sn(OH)Cl]
回答下列問題:
(1)操作I是____________。
(2)SnCl2粉末需加濃鹽酸進行溶解,請結合必要的化學方程式用平衡移動原理解釋原因:__________。
(3)加入Sn粉的作用有兩個:①調節溶液pH;②__________。
(4)反應I得到沉淀SnO,得到該沉淀的離子反應方程式是____________。
(5)酸性條件下,SnSO4還可以用作雙氧水去除劑,發生反應的離子方程式是:________________。
(6)該小組通過下列方法測定所用錫粉的純度(雜質不參與反應):
①試樣溶于鹽酸中,發生的反應為:Sn+2HCl=SnCl2+H2;
②加入過量的FeC13;
③用已知濃度的K2Cr2O7滴定生成的Fe2+,發生的反應為:
6FeCl2+ K2Cr2O7+14HCl=6FeCl3+2KCl+2CrCl3+7H2O。
取1.226g錫粉,經上述各步反應后共用去0.100mol/L K2Cr2O7溶液32.0mL。錫粉中錫的質量分數是________。(保留三位有效數字)
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長沙市高三上月考二化學試卷(解析版) 題型:選擇題
把VL含有MgSO4和K2SO4的混合溶液分成兩等份,一份加入含amolNaOH的溶液,恰好使鎂離子完全沉淀為氫氧化鎂;另一份加入含bmolBaCl2的溶液,恰好使硫酸根離子完全沉淀為硫酸鋇。則原混合溶液中鉀離子的濃度為
A.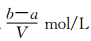 B.
B.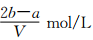 C.
C.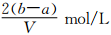 D.
D.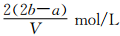
查看答案和解析>>
科目:高中化學 來源:2017屆廣西省高三上學期10月月考化學試卷(解析版) 題型:填空題
FeCl3具有凈水作用,但腐蝕設備,而聚合氯化鐵是一種新型的絮凝劑,處理污水比FeCl3高效,且腐蝕性小。請回答下列問題:
(1)檢驗FeCl3溶液中陽離子的方法是
(2)FeCl3 溶液腐蝕鋼鐵設備,除H+作用外,另一主要原因是(用離子方程式表示)
FeCl3溶液也常用于腐蝕印刷電路板,反應的離子方程式為
(3)通過控制條件,將FeCl3水解產物聚合,生成聚合氧化鐵,離子方程式為:xFe3++yH2O  Fex(OH)y(3x-y)++yH+,欲使平衡正向移動可采用的方法是 (填序號)。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移動可采用的方法是 (填序號)。
a.降溫 b.加水稀釋 c.加入NH4Cl d.加入NaHCO3
(4)為節約成本,工業上用NaClO3 氧化酸性FeCl2 廢液得到FeCl3。完成NaClO3 氧化FeCl2 的離子方程式 。
(5)處理廢水時,發現FeCl3并不能使酸性廢水中的懸浮物沉降除去,其原因是______________。
查看答案和解析>>
科目:高中化學 來源:2017屆河北邯鄲市高三上學期第二次月考化學試卷(解析版) 題型:填空題
KClO3和濃鹽酸在一定溫度下反應會生成黃綠色的易爆物二氧化氯。其變化可表述為: 2KClO3 +4HCl(濃)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)請分析該反應中電子轉移的情況:(單線橋法表示)________________________。
(2)氧化劑與還原劑的物質的量之比是 ___________________
(3)若產生標況下22.4 L Cl2,則轉移的電子的物質的量為________mol。
(4)實驗室備用的濃鹽酸質量分數為36.5%,密度為1.19 g·cm-3,為使用方便,請計算出該濃鹽酸中HCl的物質的量濃度 mol·L-1。
(5)ClO2對污水中Fe2+、Mn2+、S2-和CN- 等有明顯的去除效果。某工廠污水中含CN- a mg/L,現用ClO2將CN - 氧化,只生成兩種氣體,其離子反應方程式為為 ,處理100 m3這種污水,至少需要ClO2 _______mol。
查看答案和解析>>
科目:高中化學 來源:2017屆河北邯鄲市高三上學期第二次月考化學試卷(解析版) 題型:選擇題
根據下表信息,判斷以下敘述正確的是部分短周期元素的原子半徑及主要化合價( )
元素代號 | G | L | M | Q | R | T |
原子半徑/nm | 0.186 | 0.160 | 0.143 | 0.104[ | 0.075 | 0.066 |
主要化合價 | +1 | +2 | +3 | +6、﹣2 | +5、﹣3 | ﹣2 |
A.單質的還原性:G<L<M B.非金屬性:T<Q
C.氣態氫化物的穩定性:R>T D.L2+與T2﹣的核外電子數相等
查看答案和解析>>
科目:高中化學 來源:2017屆廣西省高三上9月月考化學試卷(解析版) 題型:填空題
NaNO2外觀和食鹽相似,又有咸味,容易使人誤食中毒。已知NaNO2能發生如下反應:
2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反應中氧化劑是________。
(2)根據上述反應,鑒別NaNO2和NaCl。可選用的物質有:①碘化鉀淀粉試紙 ②淀粉 ③白酒④食醋,你認為應選用的物質有________(填序號)。
(3)某廠廢液中,含有2%~5%的NaNO2,直接排放會造成污染,下列試劑能使NaNO2轉化為不引起二次污染的N2的是________。
A.NaCl B.NH4Cl C.HNO3 D.濃H2SO4
(4)請配平以下化學方程式 Al+ NaNO3+ NaOH— N aAlO2+ N2↑+ H2O,若反應過程中轉移5mol電子,則生成標準狀況下N2的體積為________L。
查看答案和解析>>
科目:高中化學 來源:2017屆浙江省高三上學期10月月考化學試卷(解析版) 題型:選擇題
某溫度下,在2L密閉容器中投入一定量的A、B發生反應:3A(g) + bB (g)  cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 時達到平衡,生成C的物質的量為0.8mol,反應過程如右圖所示。下列說法正確的是
cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 時達到平衡,生成C的物質的量為0.8mol,反應過程如右圖所示。下列說法正確的是
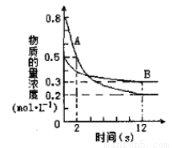
A.前12s內,A的平均反應速率為0.025mol·L-1·s-1
B.12s后,A的消耗速率等于B的生成速率
C.化學計量數之比b :c=1 :2
D.12s內,A和B反應放出的熱量為0.2Q kJ
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com