
下列敘述正確的是( )
A.使用催化劑能夠降低化學反應的反應熱(△H)
B.金屬發生吸氧腐蝕時,被腐蝕的速率和氧氣濃度無關
C.原電池中發生的反應達平衡時,該電池仍有電流產生
D.在同濃度的鹽酸中,ZnS可溶而CuS不溶,說明CuS的溶解度比ZnS的小
 優加精卷系列答案
優加精卷系列答案科目:高中化學 來源:2015-2016學年四川省成都市高二下4月月考化學試卷(解析版) 題型:選擇題
下列有關鋼鐵腐蝕與防護的說法正確的是( )
A.鋼管與電源正極連接,鋼管可被保護
B.鐵遇冷濃硝酸表面鈍化,可保護內部不被腐蝕
C.鋼管與銅管露天堆放在一起時,鋼管不易被腐蝕
D.鋼鐵發生析氫腐蝕時,負極反應是Fe﹣3e﹣═Fe3+
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西重點中學協作體高二下學期期末化學試卷(解析版) 題型:選擇題
可用于鑒別以下三種化合物的試劑組合是( )
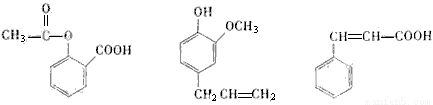
乙酰水楊酸 丁香酚 肉桂酸
①銀氨溶液 ②溴的四氯化碳溶液 ③氯化鐵溶液 ④碳酸鈉溶液
A.②與③ B.③與④ C.①與④ D.②與④
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川省資陽市高二下學期期末化學試卷(解析版) 題型:填空題
某研究性學習小組將甲、乙、丙裝置連接如圖,除G、H外所有電極均為惰性電極。電解一段時間后,D電極質量增加。試回答下列問題:
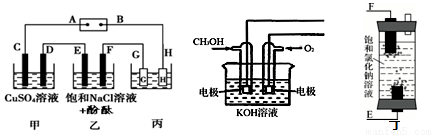
(1)電源A極是____極(填“正”或“負”);乙裝置F電極附近的現象是____。
(2)欲用丙裝置給銅鍍銀。G應該是____(填“Ag”或“Cu”)。
(3)如用甲醇燃料電池(如圖)充當電源,寫出負極的電極反應方程式:____;若用丁裝置(如圖)代替乙裝置,寫出丁裝置中反應的總化學方程式是____。
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(天津卷精編版) 題型:實驗題
反-2-己烯醛(D)是一種重要的合成香料,下列合成路線是制備D的方法之一。根據該合成路線回答下列問題:
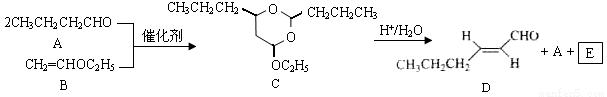
已知: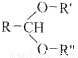
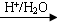 RCHO+R'OH+R"OH
RCHO+R'OH+R"OH
(1)A的名稱是__________;B分子中共面原子數目最多為__________;C分子中與環相連的三個基團中,不同化學環境的氫原子共有__________種。
(2)D中含氧官能團的名稱是__________,寫出檢驗該官能團的化學反應方程式:__________。
(3)E為有機物,能發生的反應有__________。
a.聚合反應b.加成反應c.消去反應d.取代反應
(4)B的同分異構體F與B有完全相同的官能團,寫出F所有可能的結構:________。
(5)以D為主要原料制備己醛(目標化合物),在方框中將合成路線的后半部分補充完整。
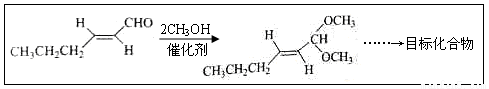
(6)問題(5)的合成路線中第一步反應的目的是__________。
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(北京卷精編版) 題型:簡答題
用零價鐵(Fe)去除水體中的硝酸鹽(NO3-)已成為環境修復研究的熱點之一。
(1)Fe還原水體中NO3-的反應原理如圖所示。
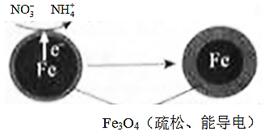
①作負極的物質是________。
②正極的電極反應式是_________。
(2)將足量鐵粉投入水體中,經24小時測定NO3—的去除率和pH,結果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小時pH | 接近中性 | 接近中性 |
鐵的最終物質形態 |
|
|
pH=4.5時,NO3—的去除率低。其原因是________。
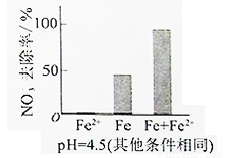
(3)實驗發現:在初始pH=4.5的水體中投入足量鐵粉的同時,補充一定量的Fe2+可以明顯提高NO3—的去除率。對Fe2+的作用提出兩種假設:
Ⅰ. Fe2+直接還原NO3—;
Ⅱ. Fe2+破壞FeO(OH)氧化層。
①做對比實驗,結果如圖所示,可得到的結論是_______。
②同位素示蹤法證實Fe2+能與FeO(OH)反應生成Fe3O4。結合該反應的離子方程式,解釋加入Fe2+提高NO3—去除率的原因:______。
(4)其他條件與(2)相同,經1小時測定NO3—的去除率和pH,結果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 約10% | 約3% |
1小時pH | 接近中性 | 接近中性 |
與(2)中數據對比,解釋(2)中初始pH不同時,NO3—去除率和鐵的最終物質形態不同的原因:__________。
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(北京卷精編版) 題型:選擇題
下列中草藥煎制步驟中,屬于過濾操作的是
A.冷水浸泡 | B.加熱煎制 | C.箅渣取液 | D.灌裝保存 |
|
|
|
|
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(新課標2卷精編版) 題型:實驗題
[化學-選修2:化學與技術]雙氧水是一種重要的氧化劑、漂白劑和消毒劑。生產雙氧水常采用蒽醌法,其反應原理和生產流程如圖所示:

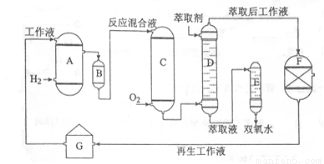
A.氫化釜B.過濾器C.氧化塔D.萃取塔E.凈化塔F.工作液再生裝置G.工作液配制裝置
生產過程中,把乙基蒽醌溶于有機溶劑配制成工作液,在一定的溫度、壓力和催化劑作用下進行氫化,再經氧化、萃取、凈化等工藝得到雙氧水。回答下列問題:
(1)蒽醌法制備雙氧水理論上消耗的原料是_______,循環使用的|原料是______,配制工作液時采用有機溶劑而不采用水的原因是______。
(2)氫化釜A中反應的化學方程式為_______,進入氧化塔C的反應混合液中的主要溶質為_______。
(3)萃取塔D中的萃取劑是____,選擇其作萃取劑的原因是______。
(4)工作液再生裝置F中要除凈殘留的H2O2,原因是______。
(5)雙氧水濃度可在酸性條件下用KMnO4溶液測定,該反應的離子方程式為_______。一種雙氧水的質量分數為27.5%,(密度為1.10g·cm3),其濃度為______mol/L。
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(海南卷精編版) 題型:選擇題
向含有MgCO3固體的溶液中滴加少許濃鹽酸(忽略體積變化),下列數值變小的是
A.c(CO32?)B.c(Mg2+) C.c(H+) D.Ksp(MgCO3)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com