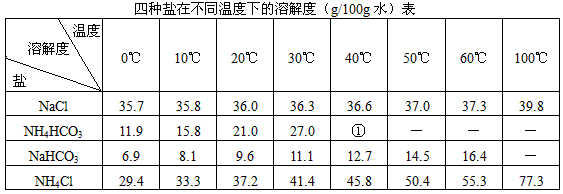
根據(jù)侯德榜制減法原理并參考下表的數(shù)據(jù),實(shí)驗(yàn)室制備純堿Na2CO2的主要步驟是:將配制好的飽和NaCl溶液倒入燒杯中加熱,控制溫度在30-35℃,攪拌下分批加入研細(xì)的NH4HCO3固體,加料完畢后,繼續(xù)保溫30分鐘,靜置、過濾得NaHCO3晶體。用少量蒸餾水洗滌除去雜質(zhì),抽干后,轉(zhuǎn)入蒸發(fā)皿中,灼燒2小時(shí),制得Na2CO3固體。
①>35°NH4HCO3會(huì)有分解
請(qǐng)回答:
(1)反應(yīng)溫度控制在30-35℃,是因?yàn)槿舾哂?5℃則 ,若低于30℃,則________________________;為控制此溫度范圍,采取的加熱方法為________________________。
(2)加料完畢后,繼續(xù)保溫30分鐘,目的是________________________。靜置后只析出NaHCO3晶體的原因是________________________。用蒸餾水洗滌NaHCO3晶體的目的是除去___________________雜質(zhì)(以化學(xué)式表示)。
(3)過濾所得的母液中含有____________(以化學(xué)式表示),需加入________________,并作進(jìn)一步處理,使NaCl溶液循環(huán)使用,同時(shí)可回收NH4Cl。
(4)測試純堿產(chǎn)品中NaHCO3含量的方法是:準(zhǔn)確稱取純堿樣品Wg,放入錐形瓶中加蒸餾水溶解,加
1-2滴酚酞指示劑,用物質(zhì)的量濃度為c(mol/L)的HCl溶液滴定至溶液由紅色到無色(指示CO32-+H+=
HCO3-反應(yīng)的終點(diǎn)),所用HCl溶液體積為V1mL,再加1-2滴甲基橙指示劑,繼續(xù)用HCl溶液滴定至溶液由黃變橙,所HCl溶液總體積為V2mL。寫出純堿樣品中NaHCO3質(zhì)量分?jǐn)?shù)的計(jì)算式:NaHCO3(%)=
____________。