
用NA表示阿伏加德羅常數的值。下列敘述中一定正確的是
A. 一定條件下某密閉容器盛2 mol N2與3 mol H2反應生成的NH3分子數為2NA
B. 25 ℃時,Ksp(BaSO4)=1×10-10,則BaSO4飽和溶液中Ba2+數目為1×10-5NA
C. 一定條件下4.6g Na完全與O2反應生成7.2 g產物,失去的電子數為0.2NA
D. 1 L 0.1mol·L-1的NaHCO3溶液中HCO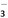 和CO
和CO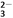 的離子數之和為0.1NA
的離子數之和為0.1NA
科目:高中化學 來源:2017屆湖南省、衡陽八中等十三校重點中學高三第一次聯考化學試卷(解析版) 題型:選擇題
下列實驗中,為實現實驗目的必須除雜,其中正確的是
實驗 | 除雜試劑 | 實驗目的 | |
① | 電石與水反應 | CuSO4溶液 | 用KMnO4酸性溶液檢驗乙炔的還原性 |
② | CH3CH2Br與NaOH溶液共熱 | HNO3溶液 | 用AgNO3溶液檢驗CH3CH2Br中的Br |
③ | 淀粉與稀H2SO4水浴共熱 | HNO3溶液 | 用銀氨溶液檢驗水解產物的還原性 |
④ | C2H5OH與濃H2SO4加熱至170℃ | NaOH溶液 | 用KMnO4溶液證明該反應為消去反應 |
⑤ | 苯與液溴反應 | CCl4 | 用AgNO3溶液證明該反應為取代反應 |
A. ①②③④⑤ B. 只有②④⑤ C. 只有②③④ D. 只有①②④⑤
查看答案和解析>>
科目:高中化學 來源:2017屆四川省樂山市高三第二次調查研究考試理科綜合化學試卷(解析版) 題型:實驗題
草酸鈷用途廣泛,可用于指示劑和催化劑制備。一種利用水鈷礦[主要成分為Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工藝流程如下:
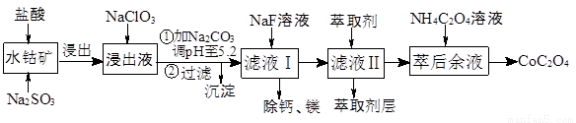
已知:①浸出液含有的陽離子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出過程中加入Na2SO3的目的是將_____________還原(填離子符號)以便固體溶解。該步反應的離子方程式為 (寫一個)。
(2)NaClO3的作用是將浸出液中的Fe2+氧化成Fe3+,氯元素被還原為最低價。該反應的離子方程式為 。
(3)利用平衡移動原理分析:加Na2CO3能使浸出液中Fe3+、Al3+轉化成氫氧化物沉淀的原因是 。
(4)萃取劑對金屬離子的萃取率與pH的關系如圖所示。濾液Ⅱ中加入萃取劑的作用是 ;使用萃取劑適宜的pH=____(填序號)左右:
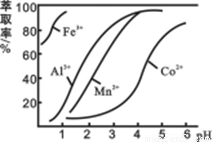
A.2.0 B.3.0 C. 4.0
(5)濾液Ⅰ“除鈣、鎂”是將溶液中Ca2+與Mg2+轉化為MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。當加入過量NaF后,所得濾液c(Mg2+)/c(Ca2+)= 。
查看答案和解析>>
科目:高中化學 來源:2017屆河南省安陽市高三第二次模擬考試理綜化學試卷(解析版) 題型:選擇題
鎂燃料電池作為一種高能化學電源,具有比能量高、使用安全方便、成本低、燃料易于貯運、污染小等特點,擁有良好的應用前景。如圖是鎂燃料電池的一種原理圖,該裝置為圓筒狀,其中心為鎂柱,圓筒為可透氣的導電材料。下列有關該鎂燃料電池的敘述正確的是
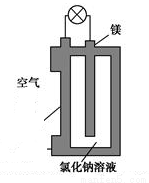
A. 該電池的總反應為2Mg+O2=2MgO
B. 反應生成O2-,該離子有正極移向負極
C. Cl-在陽極失去電子生成Cl2
D. 正極反應式為O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化學 來源:2017屆四川省高三上學期第四次月考理科綜合化學試卷(解析版) 題型:簡答題
過氧化鈣可以用于改善地表水質、處理含重金屬粒子廢水和治理赤潮,也可用于應急供氧等。實驗室可用工業碳酸鈣(含MgCO3、FeCO3等雜質)制取純凈的碳酸鈣,然后再用純的碳酸鈣制取過氧化鈣,其主要流程如下:
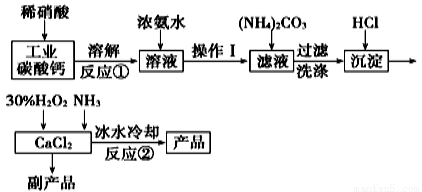
已知:CaO2·8H2O呈白色微溶于水。
(1)寫出反應①中氧化還原反應的離子方程式: ______________。
(2)向反應①后的溶液中加濃氨水的目的是: __________________。
(3)反應②常用冰水控制溫度在0℃左右,其可能原因是(寫出兩種):
①__________________;②______________。
(4)測定產品中CaO2的含量的實驗步驟是
第一步:準確稱取a g產品于有塞錐形瓶中,加入適量蒸餾水和過量的b g KI晶體,再滴入少量2 mol/L的H2SO4溶液,充分反應。
第二步:向上述錐形瓶中加入幾滴淀粉溶液。
第三步:逐滴滴入濃度為c mol·L-1的Na2S2O3標準溶液至反應終點,消耗Na2S2O3溶液V mL。
已知:I2+2S2O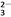 ===2I-+S4O
===2I-+S4O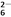 。
。
①滴定終點的現象為____________,產品中CaO2的質量分數為_________________
②某同學第一步和第二步的操作都很規范,第三步滴速太慢,這樣測得的CaO2的質量分數可能________ (填“不受影響”“偏低”或“偏高”),原因是_____________.
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省黃岡市高三3月質量檢測理科綜合化學試卷(解析版) 題型:推斷題
[化學-選修5:有機化學基礎]
親水型功能高分子M和香料N可由如圖所示途徑合成(部分產物略去):
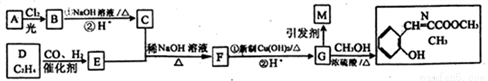
已知:
①A是芳香烴的含氧衍生物,相對分子質量為108
②有機物分子中,同一個碳原子上連接有兩個羥基時不穩定,會自動脫水
(S)R1CHO + R2CH2CHO R1CH=
R1CH=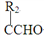 +H2O
+H2O
請回答下列問題:
(1)E的化學名稱_______,C的結構簡式 _______;
(2) M中的含氧官能團的名稱為_______,A生成B的反應類型________;
(3)寫出F到G的第一步化學方程式______________;
(4)同時滿足下列條件的G的同分異構體有____種(不考慮立體異構,不計G本身)
①苯環上有四種不同的氫
②能與NaHCO3溶液反應產生氣體
③遇氯化鐵溶液會顯色
④分子中只存在一個環
(5)仿照題中的合成線路圖,以乙醇為起始物,無機試劑任選,寫出合成聚-2-丁烯醛的線路圖:________________。
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省黃岡市高三3月質量檢測理科綜合化學試卷(解析版) 題型:選擇題
下表為元素周期表中短周期的一部分,其中Y元素的原子序數為M與N元素原子序數之和。下列說法正確的是
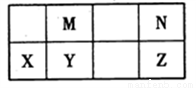
A. 氫化物的穩定性:N >Z,是因為其氫化物分子可形成氫鍵
B. 元素的非金屬性:M > Y,是因為單質M能與YN2反應生成單質Y
C. 熔沸點:YN2>MN2,是因為YN2的分子間作用力強
D. 簡單離子的半徑:N >X,是因為它們具有相同的電子層結構且X的核電荷數更大
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省高一下學期第一次月考化學試卷(解析版) 題型:計算題
將一定質量的Al、Mg混合物加入到足量的鹽酸中,充分反應后得到標準狀況下的氫氣8.96L;如果將等質量的該混合物加入到足量的NaOH溶液中,充分反應后得到標準狀況下的氫氣6.72L.
(1)當混合物與鹽酸反應時,轉移電子總物質的質量為______mol;
(2)求混合物中Al質量為 __________g Mg的質量為_________g
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省邯鄲市高二上學期期末考試化學試卷(解析版) 題型:選擇題
室溫下,分別把下列物質加入水中,能使水的電離程度增大且所得溶液呈酸性的是
A. K2SO4 B. NaHSO4 C. NaClO D. NH4NO3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com