
| A. | 原混合溶液中c(K+)為3mol/L | B. | 上述電解過程中共轉移4 mol電子 | ||
| C. | 電解得到的Cu的物質的量為0.5mol | D. | 電解后溶液上c(H+)為4 mol/L |
分析 石墨作電極電解此溶液時,陽極發生的反應為:4OH-═2H2O+O2↑+4e-,陰極上發生的電極反應為:Cu2++2e-═Cu,2H++2e-═H2↑,兩極均收集到11.2L(標況)氣體,即均生成0.5mol的氣體,陽極生成0.5mol氧氣說明轉移了2mol電子,而陰極上生成的0.5molH2只得到了1mol電子,所以剩余1mol電子由銅離子獲得,且溶液中有0.5molCu2+,再根據溶液為電中性,遵循電荷守恒可得鉀離子物質的量濃度,從該溶液中析出Cu、H2、O2,所以電解后加入一定量的Cu(OH)2可恢復為原溶液.
解答 解:石墨作電極電解此溶液時,陽極發生的反應為:4OH-═2H2O+O2↑+4e-,
陰極上發生的電極反應為:Cu2++2e-═Cu,2H++2e-═H2↑,
兩極均收集到11.2L(標況)氣體,即均生成0.5mol的氣體,陽極生成0.5mol氧氣說明轉移了2mol電子,而陰極上生成的0.5molH2只得到了1mol電子,所以剩余1mol電子由銅離子獲得,且溶液中有0.5molCu2+,
A.c(Cu2+)=$\frac{0.5mol}{0.5L}$=1mol/L,由電荷守恒可得c(K+)=6mol•L-1-1mol/L×2=4mol/L,故A錯誤;
B.由以上分析可知,述電解過程中共轉移2mole-,故B錯誤;
C.由以上分析可知,溶液中有0.5molCu2+,Cu2++2e-═Cu,所以電解得到的Cu的物質的量為0.5mol,故C正確;
D.電解后,c(K+)=4mol/L,c(NO3-)=6mol•L-1,則由電荷守恒可得c(H+)=6mol•L-1-4mol/L=2mol/L,故D錯誤;
故選C.
點評 本題考查電解池的工作原理以及溶液中的電荷守恒思想,明確離子的放電順序及發生的電極反應是解答本題的關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
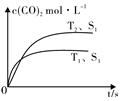 一定溫度下,在恒容密閉容器中充入2molNO2與1molO2發生反應如下:
一定溫度下,在恒容密閉容器中充入2molNO2與1molO2發生反應如下:| 0.01mol•L-1 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
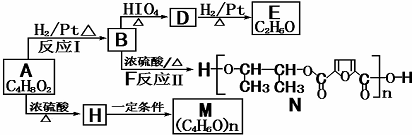
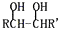 $→_{△}^{HIO_{4}}$RCHO+OHCR′
$→_{△}^{HIO_{4}}$RCHO+OHCR′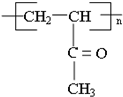
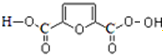 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用乙醚從黃花蒿中提取青蒿素 | |
| B. | 用氯化鐵溶液腐蝕銅制印刷電路板 | |
| C. | 在空氣凈化器中裝入活性炭層 | |
| D. | 服用阿司匹林出現水楊酸反應時用小蘇打解毒 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
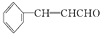 )在自然界存在于桂油中,是一種常用的植物調味油,工業上主要是按如圖路線合成的:
)在自然界存在于桂油中,是一種常用的植物調味油,工業上主要是按如圖路線合成的: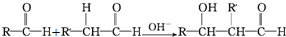
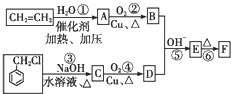
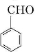 ;檢驗其中官能團的試劑為銀氨溶液或新制氫氧化銅.
;檢驗其中官能團的試劑為銀氨溶液或新制氫氧化銅.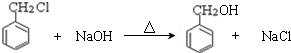 .
.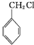 )分子中的氯元素時,是將其中的氯元素轉化為AgCl白色沉淀來進行的,其正確的操作步驟是BCDA(請按實驗步驟操作的先后次序填寫序號).
)分子中的氯元素時,是將其中的氯元素轉化為AgCl白色沉淀來進行的,其正確的操作步驟是BCDA(請按實驗步驟操作的先后次序填寫序號).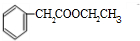
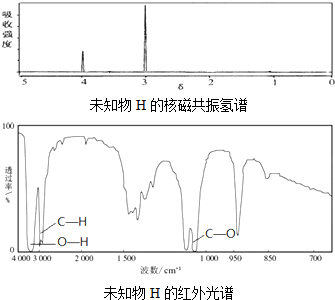
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有②④ | B. | 只有①③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
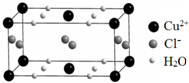 將過量的氨水加到硫酸銅溶液中,溶液最終變成深藍色,繼續加入乙醇,析出深藍色的晶體[Cu(NH3)4]SO4•H2O.
將過量的氨水加到硫酸銅溶液中,溶液最終變成深藍色,繼續加入乙醇,析出深藍色的晶體[Cu(NH3)4]SO4•H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu+HNO3(稀)→Cu(NO3)2 | |
| B. | Cu+HNO3(濃)→Cu(NO3)2 | |
| C. | Cu$→_{加熱}^{濃硫酸}$CuSO4$\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| D. | Cu$→_{加熱}^{空氣}$CuO$\stackrel{HNO_{3}}{→}$Cu(NO3)2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com