
| A. | 1/22.4mol/L | B. | V/33.6mol/L | C. | V/22.4mol/L | D. | 1/33.6mol/L |
分析 氨氣溶于水,溶液體積等于氨氣體積,圓底燒瓶的容積為VL,則氨氣和溶液的體積為VL,根據n=$\frac{V}{{V}_{m}}$計算氨氣的物質的量,再根據c=$\frac{n}{V}$計算溶液的物質的量濃度.
解答 解:氨氣極易溶于水,圓底燒瓶的容積為VL,則氨氣和溶液的體積為VL,
標況下VL氨氣的物質的量為:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
所得溶液的物質的量濃度為:c=$\frac{\frac{V}{22.4}mol}{VL}$=$\frac{1}{22.4}$mol/L,
故選A.
點評 本題考查了物質的量濃度的計算,題目難度中等,明確物質的量濃度的概念及表達式為解答關鍵,試題培養了學生的分析能力及靈活應用基礎知識的能力.


 星級口算天天練系列答案
星級口算天天練系列答案 芒果教輔達標測試卷系列答案
芒果教輔達標測試卷系列答案科目:高中化學 來源: 題型:選擇題
| 元素編號 元素性質 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半徑/10-10 m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 |
| 最高或最低化合價 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A. | 最高價氧化物的水化物酸性:④>⑤ | B. | 與水反應的劇烈程度:②>⑥ | ||
| C. | 氣態氫化物的穩定性:④>⑦ | D. | ①⑥⑦形成的化合物是離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將大小、形狀相同的鎂條和鋁條與相同濃度、相同溫度下的鹽酸反應時,兩者快慢相同 | |
| B. | 盛有相同濃度雙氧水的兩支試管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反應快 | |
| C. | 將濃硝酸分別放在冷暗處和強光下,發現強光下的濃硝酸分解得快 | |
| D. | 升高溫度,H2O2的分解速率加快,原因是反應物分子的能量增加,活化分子百分數增大,有效碰撞次數增多 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯水和碘化鉀反應:Cl2+2I-=2Cl-+I2 | |
| B. | 鹽酸與AgNO3溶液反應:HCl+Ag+=H++Ag Cl↓ | |
| C. | 氫氧化鈣溶液吸收氯氣:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 二氧化錳和鹽酸制氯氣:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將LiCoO2改寫成為氧化物的形式為Li2O•Co2O3 | |
| B. | 該電池的電解液必須使用有機溶劑主要是由于有機溶劑有良好的導電性 | |
| C. | Li是3號元素,是最輕的金屬之一,這類電池質能比高 | |
| D. | 在電池充放電時,Li+在兩個電極之間往返嵌入和脫嵌.該電池的充放電反應方程式為:LiCoO2+6C$?_{放電}^{充電}$Li1-xCoO2+LixC6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
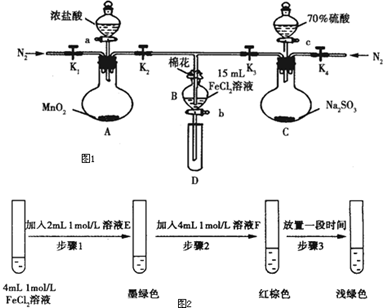
| 過程Ⅳ:B溶液中含有的離子 | 過程Ⅵ:B溶液中含有的離子 | |
| 甲 | 有Fe3+,無Fe2+ | 有SO42- |
| 乙 | 既有Fe3+、又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+、無Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com