
【題目】已知Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H=akJ/mol,平衡常數為K;測得在不同溫度下,K值如下:
FeO(s)+CO(g) △H=akJ/mol,平衡常數為K;測得在不同溫度下,K值如下:
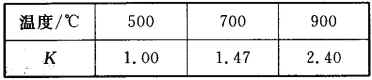
(1)若500℃時進行上述反應,CO2起始濃度為1 mol/L,CO的平衡濃度為_____。
(2)方程式中的a________0(填“大于”“小于”或“等于”)。
(3)900℃上述反應達到平衡,要使得該平衡向左移動,其他條件不變時,可以采取的措施有________(填序號)
A.縮小反應器體積 B.加入FeO
C.降低溫度到500℃ D.使用合適的催化劑
【答案】0.5mol/L 大于 C
【解析】
(1)設500℃時,CO的平衡濃度為x
Fe(s)+CO2(g) ![]() FeO(s)+CO(g)
FeO(s)+CO(g)
起始量 1mol/L 0
變化量 x x
平衡量 (1-x)mol/L x
則K=![]() x=0.5mol/L
x=0.5mol/L
答案為:0.5mol/L
(2)從表中可以看出,升高溫度,K值增大,說明平衡正向移動,正反應為吸熱反應,
方程式中的a大于0。答案為:大于
(3) A.由于反應前后氣體分子數相等,所以縮小反應器體積,平衡不發生移動,A不合題意;
B.由于FeO呈固態,所以加入FeO,對平衡不產生影響,B不合題意;
C.由于正反應為吸熱反應,所以降低溫度到500℃,平衡逆向移動,C符合題意;
D.使用合適的催化劑,對平衡不產生影響,D不合題意。
故選C。


 浙江之星課時優化作業系列答案
浙江之星課時優化作業系列答案 激活思維優加課堂系列答案
激活思維優加課堂系列答案科目:高中化學 來源: 題型:
【題目】下圖是一個實驗室制取氯氣并以氯氣為原料進行特定反應的裝置(B中有導管和一個連通外界的長頸漏斗):

(1)A是氯氣發生裝置,其中反應的化學方程式為__________________________.
(2)實驗開始時,先點燃A處的酒精燈,打開旋塞K,讓Cl2充滿整個裝置,再點燃D處酒精燈,Cl2通過C瓶后再進入D。D裝置的硬質玻璃管內盛有炭粉,發生氧化還原反應,其產物為CO2和HCl。試寫出D中反應的化學方程式:___________________;裝置C的作用是_________________ 。
(3)在E處,紫色石蕊試液的顏色由紫色變為紅色,再變為無色,其原因是__。
(4)若將E處燒杯中溶液改為澄清石灰水,反應過程中現象為___。(選填標號)
(A)有白色沉淀生成(B)無明顯變化(C)先生成白色沉淀,而后白色沉淀消失
(5)D處反應完畢后,關閉旋塞K,移去酒精燈,但由于余熱的作用,A處仍有Cl2產生,此時B中的現象是__,B的作用是___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂和鋁分別與等濃度等體積的過量稀硫酸反應,產生氣體的體積(V)與時間(t)的關系如圖所示,則下列關于反應中鎂和鋁的敘述正確的是
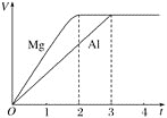
A. 二者物質的量之比為3∶2
B. 二者質量之比為3∶2
C. 二者摩爾質量之比為2∶3
D. 二者消耗H2SO4的物質的量之比為2∶3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將11.5g鈉、9g鋁、28g鐵分別投入200![]() 1
1![]() 的鹽酸中,下列說法正確的是( )
的鹽酸中,下列說法正確的是( )
A.鈉與鹽酸反應最劇烈,產生的氣體最多
B.鋁與鹽酸反應的速率僅次于鈉,但產生的氣體最多
C.鐵與鹽酸反應產生的氣體比鈉多
D.反應結束時產生的氣體一樣多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“臭堿![]() ”廣泛應用于冶金染料、皮革、電鍍等工業,可利用反應
”廣泛應用于冶金染料、皮革、電鍍等工業,可利用反應![]() 制備。已知
制備。已知![]() ,
,![]() 。下列說法正確的是( )
。下列說法正確的是( )
A.反應中生成1 mol“臭堿”時轉移電子數為![]()
B.該反應的氧化產物與還原產物的物質的量比為![]()
C.![]() 溶液中含有的陰離子數目大于
溶液中含有的陰離子數目大于![]()
D.將![]() 溶液露置于空氣中不會有
溶液露置于空氣中不會有![]() 氣體放出
氣體放出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,冰醋酸加水稀釋過程中溶液的導電能力實驗結果如圖所示:
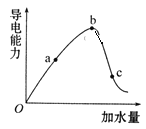
(1)“O”點為什么不導電?____________。
(2)比較a、b、c三點的c(H+)大小。____________(用“﹥”“=” 或“﹤”)
(3)a、b、c三點中,醋酸的電離程度最大的是哪一點?____________。
(4)若要使c點溶液中的c(CH3COO-)增大,試列舉兩條可行的措施______。
(5)在稀釋過程中,c(H+)、n(H+)、c(OH-)和n(CH3COOH)中,始終保持增大趨勢的是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,下列四種溶液中,由水電離生成的氫離子濃度之比是( )
①1 mol·L-1的鹽酸 ②0.1 mol·L-1的鹽酸
③0.01 mol·L-1的NaOH溶液 ④1 mol·L-1的NaOH溶液
A. 1∶10∶100∶1 B. 1∶10-1∶10-12∶10-14
C. 14∶13∶12∶14 D. 14∶13∶2∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原電池原理的發現是儲能和供能技術的巨大進步,是化學對人類的一項重大貢獻。
(1)將純鋅片和純銅片按圖方式插入100 mL相同濃度的稀硫酸中一段時間,回答下列問題:

①下列說法正確的是__________。
A.甲、乙均為化學能轉變為電能的裝置 B.乙中銅片上沒有明顯變化
C.甲中銅片質量減少、乙中鋅片質量減少 D.兩燒杯中溶液的 pH 均增大
②在相同時間內, 兩燒杯中產生氣泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③請寫出圖中構成原電池的負極電極反應式: ____________。
④當甲中溶液質量增重 31.5 克時,電極上轉移電子數目為______。
(2)圖丙為甲烷氧氣燃料電池的構造示意圖,電解質溶液的溶質是 KOH。通甲烷一極的電極反應方程式為 ______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是某學校實驗室買回的硫酸試劑標簽的部分內容。判斷下列說法正確的是( )

A. 該硫酸的濃度為9.2 mol·L-1
B. 配制480 mL 4.6 mol·L-1的稀硫酸需該H2SO4125mL
C. 該硫酸與等體積水混合質量分數變為49%
D. 取該硫酸100 mL,則濃度變為原來的![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com