
【題目】下列物質中與丁烯一定互為同系物的是
A.CH3-CH2-CH2-CH3B.CH2 = CH-CH3
C.C5H8D.C3H4
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】下圖每一方框中的字母代表一種反應物或生成物: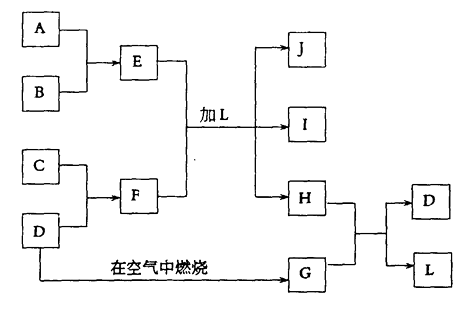
產物J是含A金屬元素的膠狀白色沉淀,I為NaCl溶液,D是淡黃色固體單質。試填寫下列空白:
(1)L的化學式為:
(2)用電子式表示F的形成過程
(3)寫出E+F+L=J+I+H反應的離子方程式:
(4)H和G之間反應的化學方程式為: , 每生成2.4克的D轉移 mol電子。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上可利用地溝油制備乙醇,乙醇再加工制備多種化工材料。

(1)A的結構簡式為_____________________________。
(2)“反應I”的現象是__________________________。
(3)B的官能團名稱為______________________。
(4)實驗室合成草酸二乙酯的步驟為:如圖,在a中加入10.6g無水乙醇、9.0g無水草酸、脫水劑甲苯、催化劑TsOH(有機酸)和2~3片碎瓷片,在74~76℃充分反應。a中所得混合液冷卻后依飲用水、飽和碳酸鈉溶液洗滌,再用無水硫酸鈉干燥。減壓蒸餾,得到草酸二乙酯12.8g。

①儀器的名稱是____,碎瓷片的作用是____________________________。
②合成過程最合適的加熱方式是__________。
a.酒精燈直接加熱 b.油浴 C.水浴 d.砂浴
③飽和碳酸鈉溶液的作用是__________________________。
④合成草酸二乙酯的化學方程式為______________________________。
⑤草酸二乙酯的產率為____________________(保留小數點后一-位)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物在工農業生產生活中有著重要應用,減少氮的氧化物在大氣中的排放是環境保護的重要內容之一。
(1)已知:N2(g)+O2(g)==2NO(g) △H =+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H =-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H =-221kJ·mol-1
若某反應的平衡常數表達式為:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)],請寫出此反應的熱化學方程式_______。
(2)N2O5在一定條件下可發生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某溫度下測得恒容密閉容器中N2O5濃度隨時間的變化如表:
4NO2(g)+O2(g),某溫度下測得恒容密閉容器中N2O5濃度隨時間的變化如表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
C(N2O6)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反應開始時體系壓強為P0,第3.00 min時體系壓強為P1,則P1:P0=_______;2min~5.00min 內,O2 的 平 均反應速率為_____________。
②一定溫度下,在恒容密閉容器中充人一定量N2O5進行該反應,能判斷反應已達到化學平衡狀態的是___。
a.NO2 和O2 的濃度比保持不變 b.容器中壓強不再變化
c.2v正(NO2)= v逆(N2 O5 ) d.氣體的平均相對分子質量為43.2,且保持不變
(3)將2molN2 和4mo1H2 置于lL的恒容密閉容器中反應。測得不同溫度、不同時間段內合成NH3 反應中N2 的轉化率,得到數據如下表:

表中a、b、25%三者由大到小的順序為_____,理由是_____。
(4)將(3)中實驗得到的混合氣體通入醋酸溶液中并恢復到25℃,當兩者恰好反應時,生成的CH3COONH4溶液呈中性,則25℃時NH3·H2O的電離平衡常數Kb=______(已知:25℃時0.18mol/LCH3COOH 溶液中c(H+)=1.8×10-3mol/L)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁(熔點660℃)是一種應用廣泛的金屬,工業上用Al2O3(熔點2045℃)和冰晶石(Na3AlF6,六氟合鋁酸鈉)混合熔融后電解制得。回答下列問題:
(1)鋁屬于活潑金屬卻能在空氣中穩定存在,原因是____(用化學用語及相關文字說明)。
(2)將0.1mo/LAlCl3溶液和10%NH4F溶液混合制取Na3AlF6。該實驗所用試管及盛裝NaF溶液的試劑瓶均為塑料材質,原因是____(用離子方程式表示)。
(3)下列關于氧化鋁的敘述正確的是_____。
A.氧化鋁可以治療胃酸過多 B.氧化鋁因為熔點高,可以作耐火材料
C.氧化鋁是鋁熱劑的成分之一 D.氧化鋁是天然藍寶石的主要成分
(4)以Al 和NiO(OH)為電極,NaOH 溶液為電解液組成一種新型電池,放電時NiO(OH)轉化為Ni(OH)2,該電池反應的化學方程式是________。
(5)某工廠排放出有毒物質NOC1,它遇水就會生成NO3-。NOCl 分子中各原子均滿足8電子穩定結構,則NOCl的電子式為____。水源中的NO3-對人類健康會產生危害,為了降低水源中NO3-的濃度,有研究人員建議在堿性條件下用鋁粉將NO3-還原為N2,該反應的離子方程式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘及其化合物在生產、生活和科技等方面都有著重要的應用。回答下列問題:
(1)已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=—1966 kJmol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=—1200 kJmol-1 。
則5CO(g)+I2O5(s)=5CO2(g)+I2(s)的△H= __________________________。
(2)碘不易溶于水,但易溶于碘化鉀溶液并生成多碘離子,反應如下:
① I2(s)+I-(aq)![]() I3-(aq) △H<0; ② I2 (s)+2I-(aq)
I3-(aq) △H<0; ② I2 (s)+2I-(aq)![]() I42-(aq)。
I42-(aq)。
溫度降低時,反應①的平衡常數將______________(填“增大”“減小”或“不變”);反應②的平衡常數的表達式為K=__________________________。
(3)碘與鎢在一定溫度下,可發生如下可逆反應:W(s)+I2(g)![]() WI2(g)。現準確稱取0.508g碘和0.736g金屬鎢放置于50.0mL的密閉容器中,并加熱使其反應。如圖是混合氣體中的WI2蒸氣的物質的量隨時間變化關系的圖象[n(WI2)~t],其中曲線Ⅰ(0~t2時間段)的反應溫度為450℃,曲線Ⅱ(從t2時刻開始)的反應溫度為530℃。
WI2(g)。現準確稱取0.508g碘和0.736g金屬鎢放置于50.0mL的密閉容器中,并加熱使其反應。如圖是混合氣體中的WI2蒸氣的物質的量隨時間變化關系的圖象[n(WI2)~t],其中曲線Ⅰ(0~t2時間段)的反應溫度為450℃,曲線Ⅱ(從t2時刻開始)的反應溫度為530℃。
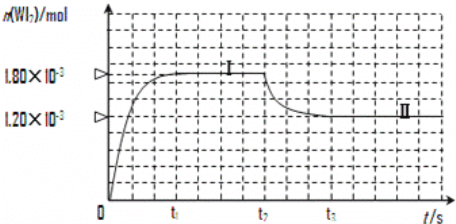
① 該反應△H____________0(填“>”或“<”)。
② 反應從開始到t1(t1= 3 min)時間內 I2 的平均反應速率v(I2)=_________。
③ 在450℃時,該反應的平衡常數K的值為__________________。
④ 能夠說明上述反應已經達到平衡狀態的有________________ (填選項字母)。
A.I2與WI2的濃度相等 B. 容器內各氣體的濃度不再改變
C. 容器內混合氣體的密度不再改變 D.容器內氣體壓強不發生變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯乙烷(C8H10)可生產塑料單體苯乙烯(C8H8),其反應原理是:C8H10(g)C8H8(g)+H2(g)△H=120kJ·mol-1某溫度下,將0.40mol苯乙烷,充入2L真空密閉容器中發生反應,測定不同時間該容器內氣體物質的量,得到數據如下表:
時間/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)當反應進行到20min時,該段時間內H2的平均反應速率是。
(2)該溫度下,該反應的化學平衡常數是。
(3)若保持其他條件不變,用0.40 mol H2(g)和0.40mol C8H8(g)合成C8H10(g),當有30kJ熱量放出時,該反應中H2的轉化率是。此時,該合成反應是否達到了平衡狀態?(填“是”或“否”)。
(4)工業上以高溫水蒸氣作為反應體系的稀釋劑(不參與反應),C8H10(g)的平衡轉化率與水蒸氣的用量、體系的溫度、壓強的關系如圖Ⅰ、圖Ⅱ所示。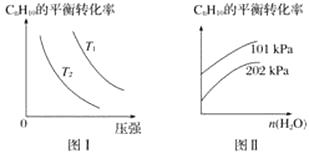
①由圖Ⅰ可知,T1T2(填“大于”、“小于”或“等于”)。
②由圖Ⅱ可知,當其他條件不變時,水蒸氣的用量越大,C8H10的平衡轉化率將(填“越大”、“越小”或“不變”),原因是。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com