
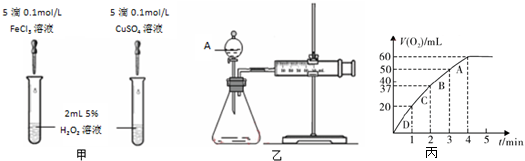
分析 (1)比較反應速率的大小可通過生成氣泡的快慢來判斷,比較金屬陽離子的催化效果要排斥陰離子的干擾;
(2)A儀器名稱是分液漏斗,檢驗裝置氣密性的方法是:關閉分液漏斗的活塞,將注射器活塞向外拉出一段,過一會后看其是否回到原位;該反應是通過反應速率分析的,所以根據v=$\frac{△V}{△t}$分析;
(3)①在二氧化錳催化作用下,雙氧水分解生成氧氣和水;
②根據圖象確定生成氧氣的體積;
③根據v=$\frac{△V}{△t}$比較反應速率快慢;
④根據氧氣的量計算雙氧水的物質的量,再根據C=$\frac{n}{V}$計算物質的量濃度.
解答 解:(1)該反應中產生氣體,可根據生成氣泡的快慢判斷,氯化鐵和硫酸銅中陰陽離子都不同,無法判斷是陰離子起作用還是陽離子起作用,硫酸鈉和硫酸銅陰離子相同,可以消除陰離子不同對實驗的干擾,
故答案為:產生氣泡的快慢;消除陰離子不同對實驗的干擾;
(2)A儀器名稱是分液漏斗,根據v=$\frac{△V}{△t}$知,還需要測定產生40mL氣體所需的時間,
故答案為:分液漏斗;產生40mL氣體所需的時間;
(3)①在二氧化錳作催化劑條件下,雙氧水分解生成水和氧氣,反應方程式為:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
故答案為:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
②根據圖象知,第4分鐘時,隨著時間的推移,氣體體積不變,所以實驗時放出氣體的總體積是60 mL,
故答案為:60;
③根據v=$\frac{△V}{△t}$知,A、B、C、D各點反應速率快慢的順序為D>C>B>A,
故答案為:D>C>B>A;
④設雙氧水的物質的量為x,
2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑
2mol 22.4L
x 0.06L
x=0.0054mol,
所以其物質的量濃度=$\frac{0.0054mol}{0.05L}$=0.11 mol•L-1,
故答案為:0.11mol/L.
點評 本題考查實驗方案設計,側重于綜合考查學生的實驗設計和分析能力,根據v=$\frac{△V}{△t}$來設計實驗,通過得到氣體的體積和時間的關系確定影響反應速率的因素,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na、Mg與水反應產生堿和氫氣,Fe與在一定條件下水反應也生成堿和氫氣 | |
| B. | CaC2能水解:CaC2+2H2O═Ca(OH)2+C2H2↑;則Al4C3也能水解:Al4C3+12H2O═4Al(OH)3↓+3CH4↑ | |
| C. | Fe能置換硫酸銅溶液的銅;則Na也能置換硫酸銅溶液的銅 | |
| D. | 工業上電解熔融MgCl2的制取金屬鎂;則也可以用電解熔融AlCl3的制取金屬鋁 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯乙烷與NaOH溶液共熱,在水解后的溶液中加入硫酸,再加入AgNO3溶液檢驗Cl- | |
| B. | 將電石和水反應后的氣體通入溴水中,如果溴水褪色,證明乙炔和溴發生了反應 | |
| C. | 實驗室制溴苯時,將苯與液溴混合后加到有鐵絲的反應容器中 | |
| D. | 向苯酚濃溶液中滴入少量濃溴水可觀察到白色三溴苯酚沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
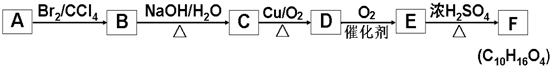
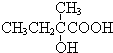
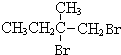 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$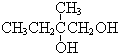 +2NaBr,反應類型取代反應
+2NaBr,反應類型取代反應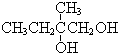 +O2+O2$\stackrel{催化劑}{→}$2
+O2+O2$\stackrel{催化劑}{→}$2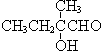 +2H2O,反應類型氧化反應
+2H2O,反應類型氧化反應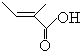 、
、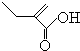 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | m=5,n=l | B. | m=3,n=5 | C. | m=3,n=4 | D. | m=3,n=6 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com