
【題目】用質量分數為36.5%的濃鹽酸(密度為1.16 g·cm-3)配制成1 mol·L-1的稀鹽酸。現實驗室僅需要這種鹽酸220 mL,試回答下列問題:
(1)配制稀鹽酸時,應選用容量為________mL的容量瓶。
(2)經計算需要________mL濃鹽酸,在量取時宜選用下列量筒中的_____。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取濃鹽酸后,進行了下列操作:
①等稀釋的鹽酸的溫度與室溫一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸餾水至液面離容量瓶刻度線1~2 cm時,改用。。。
③在盛鹽酸的燒杯中注入蒸餾水,并用玻璃棒攪動,使其混合均勻。
④用蒸餾水洗滌燒杯和玻璃棒2至3次,并將洗滌液全部注入容量瓶。
上述操作中,正確的順序是(填序號)_____。其中②中的操作中。。。處填“改用________。”
(4)使用容量瓶配制溶液時,由于操作不當,會引起誤差,下列情況會影響所配溶液的濃度(填“偏高”、“偏低”或“無影響”)
①用天平(不使用游碼)稱量時,被稱量物與砝碼的位置放顛倒了____
②用量筒量取液體溶質,讀數時俯視量筒,所配溶液的濃度____
③用膠頭滴管定容時,仰視刻度線,所配溶液的濃度____
【答案】250 21.6 C ③①④② 膠頭滴管滴加蒸餾水至凹液面與刻度線相切 無影響 偏低 偏低
【解析】
(1)依據配制溶液的體積選擇容量瓶的規格;
(2)依據c=![]() 計算濃鹽酸的物質的量濃度,依據稀釋前后溶質的物質的量不變計算需要濃鹽酸體積,依次選擇合適的量筒;
計算濃鹽酸的物質的量濃度,依據稀釋前后溶質的物質的量不變計算需要濃鹽酸體積,依次選擇合適的量筒;
(3)依據配制一定物質的量濃度溶液的一般步驟排序;
(4)分析不當操作對溶質的物質的量和溶液的體積的影響,依據c=![]() 進行誤差分析。
進行誤差分析。
(1)配制250mL濃度為1mol/L的稀鹽酸,溶液的體積為250mL,所以應選擇250mL的容量瓶;
故答案為:250;
(2)量分數為37.5%的濃鹽酸(密度為1.16g/cm3)的物質的量濃度c=11.9mol/L,設需要濃鹽酸的體積為V,稀釋前后溶質的物質的量,則V×11.9mol/L=250ml×1mol/L,解得V=21.0mL,依據大而近的原則,所以應選擇25mL量筒;
故答案為:21.0;C;
(3)配制一定物質的量濃度溶液的一般步驟:計算、量取、稀釋、冷卻、移液、洗滌、定容、搖勻、裝瓶,所以正確的順序為:③①④②;
其中②中的操作中。。。處填“改用膠頭滴管滴加蒸餾水至凹液面與刻度線相切。”
(4)①用天平(不使用游碼)稱量時,被稱量物與砝碼的位置放顛倒了,則所稱固體的質量一樣多,所配溶液的濃度無影響;
②用量筒量取液體溶質,讀數時俯視量筒,則所量液體偏少,所配溶液的濃度偏低;
③用膠頭滴管定容時,仰視刻度線,則所加蒸餾水偏多,所配溶液的濃度偏低。


科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數,下列說法正確的是
A. 1 mol羥基中所含電子的數目為7NA
B. 28 g乙烯所含共用電子對的數目為4NA
C. 標準狀況下,11.2 L二氯甲烷所含的分子數為0.5NA
D. 現有乙烯、丙烯、丁烯的混合氣體共14 g,其原子數為3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列四種粒子中,半徑按由大到小的排列順序是____________(填序號)。
①基態X的原子結構示意圖:![]()
②基態Y的價電子排布式:3s23p5
③基態Z2-的電子排布圖:![]()
④W基態原子有2個能層,電子式為![]()
(2)已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的電子層結構,則A、B、C、D的原子半徑由大到小的順序是______________,離子半徑由大到小的順序是________________,原子序數由大到小的順序是__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據報道,化合物M對番茄灰霉菌有較好的抑菌活性,其合成路線如下圖所示。

已知:
回答下列問題:
(1)化合物C中的含氧官能團名稱為_________,A到B的反應類型為__________。
(2)A的名稱為____________
(3)寫出D的結構簡式:_____________________________。
(4)寫出反應②的化學方程式:____________________________________________。
(5)化合物C滿足下列條件的同分異構體有_______種,寫出其中一種有5種不同種類氫原子的同分異構體的結構簡式:_______________。
①含苯環結構,能在堿性條件下發生水解;
②能與FeCl3發生顯色反應;
③能發生銀鏡反應。
(6)已知CH3CH2CN![]() CH3CH2COOH。請以
CH3CH2COOH。請以 、CH2=CHCN和乙醇為原料合成化合物
、CH2=CHCN和乙醇為原料合成化合物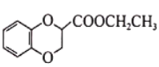 ,寫出制備的合成路線流程圖(無機試劑任用)____________________
,寫出制備的合成路線流程圖(無機試劑任用)____________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2013年3月我國科學家報道了如圖所示的水溶液鋰離子電池體系。其總反應方程式為: xLi + Li1-xMn2O4 ![]() LiMn2O4下列敘述錯誤的是
LiMn2O4下列敘述錯誤的是

A. a為電池的正極
B. 放電時,溶液中Li+從b向a遷移
C. 充電時,外接電源的負極與b相連
D. 可用Na2SO4溶液代替Li2SO4溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,某同學設計了一個燃料電池并探究氯堿工業原理和粗銅(含有少量鋅、金、銀等雜質)的精煉原理,其中乙裝置中X為陽離子交換膜。回答下列問題:

(1)甲烷燃料電池負極的電極反應式為_________。
(2)乙裝置中陽離子通過X膜向________ 極(填“Fe”或“C”)移動;丙裝置中粗銅為_______電極(填“A”或“B”)
(3)若在標況下,有2.24L氧氣參與反應,則乙裝置中右側溶液________(填“增加”或“減少”)______g,丙裝置中CuSO4濃度__________(填“增加”、“減少” 或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A~J分別表示中學化學中常見的一種物質,它們之間相互關系如下圖所示(部分反應物、生成物沒有列出),且已知G為主族元素的固態氧化物,A、B、C、D、E、F六種物質中均含同一種元素。

請回答下列問題:
(1) NaOH的電子式為__________________。
(2) G的化學式為______________________。
(3) 寫出反應④的離子方程式:________________________________________________。
(4) 寫出反應⑥的化學方程式:____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KI用于分析試劑、感光材料制藥和食品添加劑等。
制備原理如下:反應① 3I2+6 KOH =a KIO3+5KI+3H2O
反應② 3H2S+KIO3=3S↓+KI+3H2O

按照下列實驗過程,請回答有關問題。
(1)啟普發生器中發生的化學方程式為______________________,用該裝置還可以制備___________(填一種氣體化學式)。
(2)關閉啟普發生器活塞,打開滴液漏斗的活塞,滴入30%的KOH溶液,待觀察到______________________(填現象),停止滴人KOH溶液;然后______________________(填操作),待KIO3混合液和NaOH溶液氣泡速率接近相同時停止通氣。
(3)滴人硫酸溶液,并對KI混合液水浴加熱,其目的是______________________。
(4)把KI混合液倒入燒杯,加入碳酸鋇,在過濾器中過濾,過濾得到的沉淀中除含有過量碳酸鋇外,還有硫酸鋇和___________,其中加入碳酸鋇的作用是______________________。合并濾液和洗液,蒸發至析出結晶,濾出經于燥得成品。
(5)如果得到3.2g硫單質,則理論上制得的KI為___________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電離平衡常數是衡量弱電解質電離程度的物理量,已知如表數據(25℃):
化學式 | 電離平衡常數 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25℃時,下列物質的量濃度相同的四種溶液的pH由大到小的順序為_____(填字母,下同)。
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液
(2)25℃時,向NaCN溶液中通入少量CO2,所發生的化學方程式為____________________。
(3)等物質的量的Na2CO3和NaHCO3混合溶液中各離子濃度由大到小的順序為____________________。
(4)對于醋酸溶液和醋酸鈉溶液的下列說法正確的是__________。
a.稀釋醋酸溶液,醋酸的電離程度增大,而稀釋醋酸鈉溶液則醋酸鈉的水解程度減小
b.升高溫度可以促進醋酸電離,而升高溫度會抑制醋酸鈉水解
c.醋酸和醋酸鈉的混合液中,醋酸促進醋酸鈉的水解、醋酸鈉也促進醋酸的電離
d.醋酸和醋酸鈉的混合液中,醋酸抑制醋酸鈉的水解、醋酸鈉也抑制醋酸的電離
(5)25℃,已知pH = 2的高碘酸溶液與pH = 12的NaOH溶液等體積混合,所得混合液顯酸性;0.01 mol/L的碘酸或高錳酸溶液與pH = 12的NaOH溶液等體積混合,所得混合液顯中性。則高碘酸是____________(填“強酸”或“弱酸”);高錳酸是___________(填“強酸”或“弱酸”)。將可溶性的高碘酸鋇[Ba5(IO6)2]與稀硫酸混合,發生反應的離子方程式為:__________________________________________________。
(6)用生石灰吸收CO2可生成難溶電解質CaCO3,其溶度積常數Ksp=2.8×10-9。現有一物質的量濃度為2×10-4mol/L純堿溶液,將其與等體積的CaCl2溶液混合,則生成沉淀所需CaCl2溶液的最小濃度為______mol/L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com