
有A、B、C、D、E、F、G、H、I九種常見物質,它們的轉化關系(反應條件未注明)如圖所示.其中B、C、D為單質,常溫下D為固態,B、C、E、G為氣態,F為淡黃色粉末,I的焰色反應為黃色.
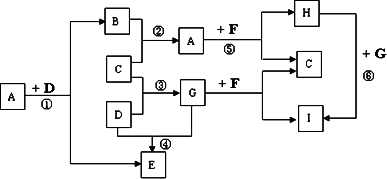
請回答:
(1)寫出F的電子式________,其化學鍵類型有________.
(2)寫出反應⑤的化學方程式________.
(3)I的是溶液呈________性(填酸性、中性或堿性),原因(用離子反應方程式表示)________.
(4)B、C單質已被應用于字宙飛船的燃料電池中,如圖所示,兩個電極均由多孔性碳構成,通入的兩種單質由孔隙逸出并在電極表面放電.b是電池的________極;a電極上的電極反應是________.

(5)在①、②、③、④、⑤五個反應中,ΔH>0的反應是________(填序號).
(6)在標準狀況下,若將11.2 L氣體G通入350 mL 2 mol/L的H溶液中,反應后溶液中離子濃度由大到小的順序是________.
|
答案:(1) (2)2Na2O2+2H2O=4NaOH+O2↑ (4)正極 H2+2OH--2e-=2H2O (5)①④ (6)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) 解析:(1)由F為淡黃色粉末、I的焰色反應為黃色,可推知F為Na2O2,又因為G為氣態、C為單質,可推知G為CO2、C為O2,I為Na2CO3;又因為A和F(Na2O2)產生O2,可推知A為H2O;又因B和O2生成水,且B為單質,故B為H2;又因為A(H2O)和D反應生成H2,且D為單質,可推知D為碳;D(碳)和CO2反應生成E,故E為CO. (5)反應①為C+H2O=CO+H2,反應④為CO2+C=2CO,它們都是吸熱反應,其他反應為放熱反應. (6)0.5 mol通入0.7 mol NaOH的溶液中,生成0.2 mol Na2CO3、0.3 mol NaHCO3,故在它們的溶液中離子濃度大小順序為c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+). |


 同步奧數系列答案
同步奧數系列答案科目:高中化學 來源: 題型:






查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
32 16 |
32 16 |
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:






查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com