
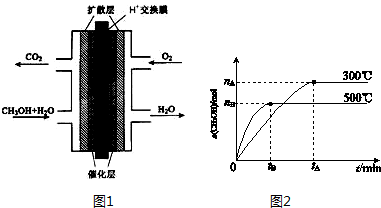
分析 Ⅰ.(1)依據燃燒熱概念是1mol可燃物完全燃燒生成穩定氧化物放出的熱量,題干所給量結合熱化學方程式書寫方法,標注物質聚集狀態和對應焓變;
(2)由蓋斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol-1、③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,①+③得到反應②;
(3)甲醇燃料電池中,甲醇為負極,正極發生還原反應,電極反應式為:O2+4H++4e-═2H2O;
Ⅱ.(1)根據化學平衡常數為生成物的濃度冪之積除以反應物的濃度冪之積,列出平衡常數的表達式;根據升高溫度乙醇的物質的量減小,平衡逆向移動,判斷平衡常數的變化;
(2)根據化學反應速率是υ(H2)=2υ(CH3OH)計算;
(3)達到平衡時,正逆反應速率相等,混合氣體的平均相對分子質量不再改變,CO、H2、CH3OH的濃度不再改變;
(4)將容器的容積壓縮到原來的$\frac{1}{2}$,壓強增大,反應速率增大,平衡向正反應方向移動,以此判斷.
解答 解:Ⅰ.(1)在25℃、101kPa下,1mol CH3OH液體完全燃燒生成CO2和液態水時放出熱量726.51kJ,則表示甲醇燃燒熱的熱化學方程式為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1,
故答案為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1;
(2)由蓋斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol-1、③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,①+③得到反應②,則△H2=+49.0kJ•mol-1+(-241.8kJ•mol-1)=-192.8kJ•mol-1,故答案為:-192.8;
(3)甲醇燃料電池中,甲醇中C元素的化合價升高,則甲醇為負極,正極發生還原反應,電極反應式為:O2+4H++4e-═2H2O,故答案為:負;O2+4H++4e-═2H2O;Ⅱ.(1)化學平衡常數為生成物的濃度冪之積除以反應物的濃度冪之積,反應物的生成物都是氣體,故平衡常數表達式為K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,由圖象可知升高溫度乙醇的物質的量減少,平衡向逆反應方向移動,K減小,
故答案為:$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;減小;
(2)υ(CH3OH)=$\frac{{n}_{B}}{{n}_{t}×3L}$mol/(L.min),故υ(H2)=2υ(CH3OH)=$\frac{2{n}_{B}}{3{t}_{B}}$mol/(L.min),故答案為:$\frac{2{n}_{B}}{3{t}_{B}}$mol/(L.min);
(3)達到平衡時,正逆反應速率相等,混合氣體的平均相對分子質量不再改變,CO、H2、CH3OH的濃度不再改變,在體積不變時,氣體的密度不變,不能作為判斷是否達到平衡狀態的依據,
故答案為:c、d;
(4)將容器的容積壓縮到原來的$\frac{1}{2}$,壓強增大,正逆反應速率都增大,平衡向正反應方向移動,CH3OH的物質的量增加,氫氣的物質的量減少,但濃度增大,甲醇的物質的量增多,故有c(H2)/c(CH3OH)減小,
故答案為:c、d.
點評 本題考查化學平衡的影響因素和化學平衡的標志等問題,題目難度中等,注意外界條件對化學平衡移動的影響以及平衡狀態的判斷角度.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 物質(括號中為雜志) | 所加試劑 | 操作方法 |
| 酒精(水) | 新制生石灰 | 蒸餾 |
苯甲酸(沙子) | / | 過濾 |
| 甲烷(乙烯) | 溴水(溴的四氯化碳溶液) | 洗氣 |
| 溴苯(溴) | 氫氧化鈉溶液 | 分液 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

| 丙分子式 | C16H14O2 |
| 部分性質 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |

 $→_{△}^{O_{2}/Cu}$Y$→_{Ⅱ}^{一定條件}$乙
$→_{△}^{O_{2}/Cu}$Y$→_{Ⅱ}^{一定條件}$乙 (注明反應條件).
(注明反應條件).
 .
. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
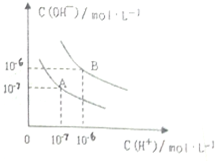 水的電離平衡曲線如圖所示.
水的電離平衡曲線如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ,W是否存在順反異構?否 (填“是”或“否”).
,W是否存在順反異構?否 (填“是”或“否”). 是W與水在一定條件下發生加成反應的產物的同系物.
是W與水在一定條件下發生加成反應的產物的同系物. +2Na→
+2Na→ +H2↑.
+H2↑. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解池的陽極發生氧化反應,陰極上發生還原反應 | |
| B. | 不能自發進行的氧化還原反應可通過電解的原理實現 | |
| C. | 電鍍時,電鍍池里的陽極材料發生氧化反應 | |
| D. | 電解飽和食鹽水時,陽極得到,NaOH溶液和氫氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com