
分析 碳在氧氣中燃燒,氧氣不足發生反應2C+O2$\frac{\underline{\;點燃\;}}{\;}$2CO,氧氣足量發生反應C+O2$\frac{\underline{\;點燃\;}}{\;}$CO2.3.6g碳的物質的量為0.3mol,6.4g的氧氣的物質的量為0.2mol,n(C):n(O2)=3:2,介于2:1與1:1之間,所以上述反應都發生.令生成的CO為xmol,CO2為ymol,根據碳元素與氧元素守恒列方程計算x、y的值,計算生成ymol二氧化碳的熱量,放出的總熱量減去生成二氧化碳,放出的熱量為生成xmolCO放出的熱量,據此計算1molC與O2反應生成CO的反應熱△H.
解答 解:碳在氧氣中燃燒,氧氣不足發生反應2C+O2$\frac{\underline{\;點燃\;}}{\;}$2CO,氧氣足量發生反應C+O2$\frac{\underline{\;點燃\;}}{\;}$CO2.
3.6g碳的物質的量為$\frac{3.6g}{12g/mol}$=0.3mol,6.4g的氧氣的物質的量為$\frac{6.4g}{32g/mol}$=0.2mol,n(C):n(O2)=3:2,
介于2:1與1:1之間,所以上述反應都發生.
令生成的CO為xmol,CO2為ymol,
根據碳元素守恒有x+y=0.3,根據氧元素守恒有x+2y=0.2×2,聯立方程,解得x=0.2,y=0.1.
單質碳的燃燒熱為Y kJ/mol,所以生成0.1mol二氧化碳放出的熱量為0.1mol×Y kJ/mol=0.1YkJ,
所以生成0.2molCO放出的熱量為XkJ-0.1YkJ.
由于碳燃燒為放熱反應,所以反應熱△H的符號為“-”,
故1mol C與O2反應生成CO的反應熱△H=-$\frac{XkJ-0.1YkJ}{0.2mol}$=-(5X-0.5Y)kJ/mol.
故答案為:-(5X-0.5Y)kJ/mol.
點評 考查反應熱的計算,難度不大,判斷碳與氧氣反應產物中一氧化碳與二氧化碳的物質的量是關鍵,注意反應熱△H的單位與符號,容易忽略.


 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案科目:高中化學 來源: 題型:解答題
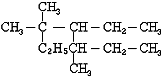 完成下列小題
完成下列小題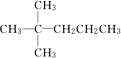 ,
,查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
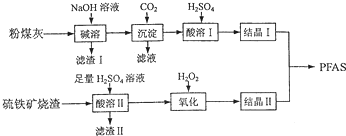
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4+2O2$\stackrel{點燃}{→}$CO2+2H2O | B. | 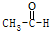 +H2$\stackrel{催化劑}{→}$CH3CH2OH +H2$\stackrel{催化劑}{→}$CH3CH2OH | ||
| C. | H2+Cl2═2HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 目前科學家已經制得單原子層鍺,其電子遷移率是硅的10倍,有望取代硅用于制造更好的晶體管 | |
| B. | 石油裂解的主要目的是提高汽油等輕質油的產量與質量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等氣態短鏈烴 | |
| C. | 鍍層破損后,鍍錫鐵片比鍍鋅鐵片更耐腐蝕 | |
| D. | 近期在西非國家爆發的埃博拉疫情呈加速蔓延之勢,已知該病毒對化學藥品敏感,乙醇、次氯酸鈉溶液均可以將病毒氧化而達到消毒的目的 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com