
在密閉容器中,對于反應:N2(g)+3H2(g)  2NH3(g),在反應起始時N2和H2分別為10mol和30mol,當達到平衡時,N2的轉化率為30%。若以NH3為起始反應物,反應條件與上述反應相同時,欲使其達到平衡時各成分的百分含量與前者相同,則NH3的起始物質的量和它的轉化率,正確的是
2NH3(g),在反應起始時N2和H2分別為10mol和30mol,當達到平衡時,N2的轉化率為30%。若以NH3為起始反應物,反應條件與上述反應相同時,欲使其達到平衡時各成分的百分含量與前者相同,則NH3的起始物質的量和它的轉化率,正確的是
A.40mol;35% B.20mol;30%
C.20mol;70% D.10mol;50%
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2016屆湖北省高三8月月考(開學摸底)化學試卷(解析版) 題型:選擇題
1.52 g銅鎂合金完全溶解于50 mL密度為1.40 g/mL、質量分數為63%的濃硝酸中,得到NO2和N2O4的混合氣體1120 mL(標準狀況),向反應后的溶液中加入1.0 mol/L NaOH溶液,當金屬離子全部沉淀時,得到2.54 g沉淀。下列說法不正確的是
A.得到2.54 g沉淀時,加入NaOH溶液的體積是700 mL
B.該合金中銅與鎂的物質的量之比是2:1
C.該濃硝酸中HNO3的物質的量濃度是14.0 mol/L
D.NO2和N2O4的混合氣體中,NO2的體積分數是80%
查看答案和解析>>
科目:高中化學 來源:2016屆安徽省高三第一次聯考化學試卷(解析版) 題型:選擇題
阿托酸是一種常用的醫藥中間體,其結構如圖所示: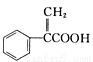 。下列有關說法正確的是
。下列有關說法正確的是
A.阿托酸的分子式為C9 H8O2
B.lmol阿托酸最多能和4mol Br2發生加成反應
C.阿托酸分子中所有碳原子一定在同一平面
D.阿托酸能發生取代、加成、水解等反應
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省白城市高一上第一次月考化學試卷(解析版) 題型:選擇題
在“粗鹽提純”的實驗中,蒸發時正確的操作是
A.把渾濁的液體倒入蒸發皿內加熱
B.開始析出晶體后再用玻璃棒攪拌
C.待水分完全蒸干后停止加熱
D.蒸發皿中出現大量固體時即停止加熱
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省邯鄲市高二上第一次月考化學試卷(解析版) 題型:實驗題
(12分)某學生用已知物質的量濃度的鹽酸來測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑。請填寫下列空白:
(1)用標準的鹽酸滴定待測的NaOH溶液時,左手握酸式滴定管的活塞,右手搖動錐形瓶,眼睛注視_____,直到因加入一滴鹽酸后,溶液由 色變為 色,并______為止。
(2)下列操作中可能使所測NaOH溶液的濃度數值偏低的是( )
A.酸式滴定管未用標準鹽酸潤洗就直接注入標準鹽酸
B.滴定前盛放NaOH溶液的錐形瓶用蒸餾水洗凈后沒有干燥
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失
D.讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數
(3)若滴定開始和結束時,酸式滴定管中的液面如圖所示,則起始讀數為_____mL,終點讀數為_____mL,所用鹽酸溶液的體積為_____mL。
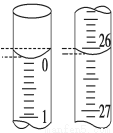
(4)某學生根據3次實驗分別記錄有關數據如下表:
滴定次數 | 待測NaOH溶液的體積/mL | 0.100 0 mol·L-1鹽酸的體積/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依據上表數據列式計算該NaOH溶液的物質的量濃度。
查看答案和解析>>
科目:高中化學 來源:2016屆浙江省高三上學期第一次模擬考試化學試卷(解析版) 題型:選擇題
一定溫度下,l mol X和n mol Y在體積為2L的密閉容器中發生如下反應:X(g)+Y(g) 2Z(g)+M(s),5min后達到平衡,此時生成2a mol Z。下列說法正確的是
2Z(g)+M(s),5min后達到平衡,此時生成2a mol Z。下列說法正確的是
A.用M表示此反應的反應速率γ(M)=0.1a mol·(L·min)-1
B.當混合氣體的質量不再發生變化時,說明反應達到平衡狀態
C.向平衡后的體系中加入l mol M,平衡向逆反應方向移動
D.向上述平衡體系中再充入l mol X,平衡正向移動,因為此時γ正增大,γ逆減小
查看答案和解析>>
科目:高中化學 來源:2016屆云南省高三上學期第一次月考化學試卷(解析版) 題型:選擇題
已知A是一種金屬單質,B顯淡黃色,其轉化關系如圖所示,則C的以下性質錯誤的是
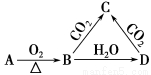
A.溶液呈堿性 B.與澄清石灰水反應產生白色沉淀
C.與足量鹽酸反應放出氣體 D.受熱易分解
查看答案和解析>>
科目:高中化學 來源:2016屆甘肅省天水市高三上第一次檢測考試化學試卷(解析版) 題型:填空題
(10分)氧化還原反應在生產、生活中應用廣泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化劑.用所學知識回答問題:
(1) 3H2SO4+2 KMnO4+5H2O2=K2SO4+2MnSO4+5 O2↑+8 H2O,當有6 mol H2SO4參加反應的過程中,有 mol還原劑被氧化。
(2)在稀硫酸中,KMnO4能將H2C2O4氧化為CO2。該反應的化學方程式為 .
(3)取300mL 0.2mol/L的KI溶液與一定量的酸性KMnO4溶液恰好反應,生成等物質的量的I2和KIO3,則消耗KMnO4的物質的量的是 mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黃色變為淺綠色,過一會又變為棕黃色,溶液先變為淺綠色的離子方程式是 ,又變為棕黃色的原因是 .
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省雙鴨山市高三上第一次月考化學試卷(解析版) 題型:填空題
(14分)硫酸是用途廣泛的化工原料,可作脫水劑、吸水劑、氧化劑和催化劑等。
(1)工業制硫酸銅的方法很多。
①方法一、用濃硫酸和銅制取硫酸銅。該反應的化學方程式是_____ _,此法的最大缺點是_ ______。
②方法二、用稀硫酸、銅和氧化鐵制取硫酸銅,生產的主要過程如下圖所示:

稀硫酸、銅和氧化鐵反應的離子方程式是__ __;向混合溶液中通入熱空氣的反應的離子方程式是_ ____;由濾液得到無水硫酸銅的實驗操作是 ______。
(2)氨法脫硫技術可吸收硫酸工業尾氣中的二氧化硫,同時制得硫酸銨。主要的工藝流程如下圖所示:

①吸收塔中發生反應的化學方程式是____ ___。
②有數據表明,吸收塔中溶液的pH在5.5~6.0之間,生產效率較高。當控制一定流量的尾氣時,調節溶液的pH的簡便方法是___ ____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com