
【題目】(題文)海帶含有豐富的碘,為了從海帶中提取碘,某研究性學習小組設(shè)計并進行了以下實驗:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
請?zhí)顚懴铝锌瞻祝?
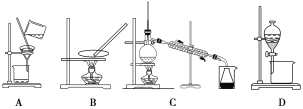
(1)步驟③和⑤的實驗操作名稱分別是________________、____________。
(2)步驟⑥的目的是從含碘苯溶液中分離出單質(zhì)碘和回收苯,該步驟應選擇的實驗裝置是________,該裝置的操作名稱為__________。
(3)步驟④反應的離子方程式是___________________________。
(4)請設(shè)計一個簡單的實驗方案,檢驗提取碘后的水溶液中是否還含有單質(zhì)碘:______。
【答案】過濾 萃取(分液)C蒸餾2I-+H2O2+2H+===I2+2H2O取少量溶液于試管中,滴加少量淀粉溶液,若溶液變藍,說明原溶液中含有單質(zhì)碘,反之則無
【解析】
(1)步驟③是分離固體和液體,則實驗操作為過濾,步驟⑤是將碘單質(zhì)從碘水中分離出來,實驗操作為萃取分液;
(2)步驟⑥是利用互溶的兩種液體的沸點不同來分離,則實驗操作為蒸餾,A~D分別是過量、蒸發(fā)、蒸餾、分液,因此答案選C;
(3)碘離子在酸性條件下可被H2O2氧化成單質(zhì)碘,H2O2被還原為水,反應的離子方程式為2I-+H2O2+2H+=I2+2H2O;
(4)由于淀粉遇碘單質(zhì)會變藍,故取少量溶液于試管中,滴加少量淀粉溶液,若溶液變藍,說明原溶液中含有單質(zhì)碘,反之則無。


科目:高中化學 來源: 題型:
【題目】工業(yè)上用合成氣(CO和H2)制取乙醇的反應為2CO+4H2![]() CH3CH2OH+H2O。研究發(fā)現(xiàn),使用TiO2作為載體負載銠基催化劑具有較高的乙醇產(chǎn)量。回答下列問題:
CH3CH2OH+H2O。研究發(fā)現(xiàn),使用TiO2作為載體負載銠基催化劑具有較高的乙醇產(chǎn)量。回答下列問題:
(1)Ti基態(tài)原子核外電子排布式為_________。和O同一周期且元素的第一電離能比O大的有______(填元素符號),和O同一周期且基態(tài)原子核外未成對電子數(shù)比O多的有____(填元素符號)。
(2)H2O分子中O原子的價層電子對數(shù)是________,CH3CH2OH分子中亞甲基(-CH2-)上的C原子的雜化形式為_______。
(3)在用合成氣制取乙醇反應所涉及的4種物質(zhì)中,沸點從低到高的順序為_________,原因是__________。
(4)工業(yè)上以CO、O2、NH3為原料,可合成氮肥尿素[CO(NH2)2],CO(NH2)2分子中含有的σ鍵與π鍵的數(shù)目之比為_________。
(5)C元素與N元素形成的某種晶體的晶胞如圖所示(8個碳原子位于立方體的頂點,4個碳原子位于立方體的面心,4個氮原子在立方體內(nèi)),該晶體硬度超過金剛石,成為首屈一指的超硬新材料。
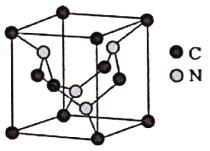
①該晶體硬度超過金剛石的原因是____________。
②已知該晶胞的密度為d g/cm3,N原子的半徑為r1cm,C原子的半徑為r2cm,設(shè)NA為阿伏加德羅常數(shù),則該晶胞的空間利用率為________(用含d、r1、r2、NA的代數(shù)式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳的氧化物對環(huán)境的影響較大,CO是燃煤工業(yè)生產(chǎn)中的大氣污染物,CO2則促進了地球的溫室效應。給地球生命帶來了極大的威脅。
(1)已知:①甲醇的燃燒熱△H=-726.4kJ·mol-1
②H2(g)+ ![]() O2(g)=H2O(l) △H=-285.8kJ·mol-1。
O2(g)=H2O(l) △H=-285.8kJ·mol-1。
則二氧化碳和氫氣合成液態(tài)甲醇,生成液態(tài)水的熱化學方程式為_____________________________。
(2)二氧化碳合成CH3OH 的熱化學方程式為CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1,過程中會產(chǎn)生副反應:CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H1,過程中會產(chǎn)生副反應:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2。圖1是合成甲醇反應中溫度對CH3OH、CO的產(chǎn)率影響曲線圖,△H2________0(填“>”或“<”)。增大反應體系的壓強,合成甲醇的反應速率___________(填“增大”“減小”或“ 不變”),副反應的化學平衡________(填“向正反應方向”“向逆反應方向”或“不”)移動。
CO(g)+H2O(g)△H2。圖1是合成甲醇反應中溫度對CH3OH、CO的產(chǎn)率影響曲線圖,△H2________0(填“>”或“<”)。增大反應體系的壓強,合成甲醇的反應速率___________(填“增大”“減小”或“ 不變”),副反應的化學平衡________(填“向正反應方向”“向逆反應方向”或“不”)移動。
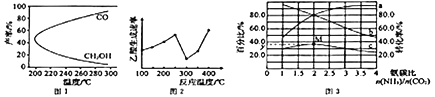
(3)以某些過渡金屬氧化物作催化劑,二氧化碳與甲烷可轉(zhuǎn)化為乙酸:CO2(g) +CH4(g)![]() CH3COOH(g) △H=+36.0kJ·mol-1。不同溫度下,乙酸的生成速率變化曲線如圖2。結(jié)合反應速率,使用催化劑的最佳溫度是________℃,欲提高CH4的轉(zhuǎn)化率,請?zhí)峁┮环N可行的措施:____________________________。
CH3COOH(g) △H=+36.0kJ·mol-1。不同溫度下,乙酸的生成速率變化曲線如圖2。結(jié)合反應速率,使用催化劑的最佳溫度是________℃,欲提高CH4的轉(zhuǎn)化率,請?zhí)峁┮环N可行的措施:____________________________。
(4)一定條件下,CO2 與NH3 可合成尿素[CO(NH2)2]:CO2(g)+2NH3(g)![]() CO(NH2)2(g)+H2O(g)△H。某溫度下。在容積為1L的恒容密閉容器中,加入一定氨碳比
CO(NH2)2(g)+H2O(g)△H。某溫度下。在容積為1L的恒容密閉容器中,加入一定氨碳比![]() 的3molCO2 和NH3的混合氣體。圖3是有關(guān)量的變化曲線,其中表示NH3轉(zhuǎn)化率的是曲線________(填“a”或“b”),曲線c 表示尿素在平衡體系中的體積分數(shù)變化曲線,則M點的平衡常數(shù)K=________,y=________。
的3molCO2 和NH3的混合氣體。圖3是有關(guān)量的變化曲線,其中表示NH3轉(zhuǎn)化率的是曲線________(填“a”或“b”),曲線c 表示尿素在平衡體系中的體積分數(shù)變化曲線,則M點的平衡常數(shù)K=________,y=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.在一定溫度下將2molA和2molB兩種氣體混合于2L密閉容器中,發(fā)生如下反應:3A(g)+B(g)=- 2C(g)+ 2D(g),2 分鐘末反應達到平衡狀態(tài),生成了0.6mol D,回答下列問題:
(1)用D表示2min內(nèi)的平均反應速率為____________,A的轉(zhuǎn)化率為_____________。
(2)如果縮小容器容積(溫度不變),則平衡體系中混合氣體的密度_________(填“增大”、“減少”或“不變”)。
(3)若開始時只加C和D各4/3mol,要使平衡時各物質(zhì)的質(zhì)量分數(shù)與原平衡相等,則還應加入_____________mol B 物質(zhì)。
(4)若向原平衡體系中再投入1molA和1molB,B的轉(zhuǎn)化率_________(填“增大”、“減少”或“不變”)。
II.有人設(shè)計出利用CH3OH 和O2的反應,用鉑電極在KOH 溶液中構(gòu)成原電池。電池的總反應類似于CH3OH 在O2中燃燒,則:
(1)每消耗1molCH3OH 可以向外電路提供___________mole-;
(2)負極電極反應式為________________________。
(3)電池放電后,溶液的pH_________(填“增大”、“減少”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳跟濃硫酸共熱產(chǎn)生的混合氣體X和銅跟濃硝酸反應產(chǎn)生的混合氣體Y同時通入盛有足量氯化鋇溶液的洗氣瓶中(如圖),下列說法正確的是( )

A. 洗氣瓶中產(chǎn)生的沉淀是BaCO3
B. 在Z導管出來的氣體中無CO2
C. 洗氣瓶中產(chǎn)生的沉淀是BaSO3
D. 在Z導管口有紅棕色氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學校化學學習小組為探究二氧化氮的性質(zhì),按如圖所示裝置進行實驗。
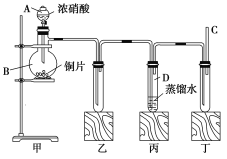
回答下列問題:
(1)裝置甲中盛放濃硝酸的儀器A的名稱是_____,該裝置中發(fā)生反應的化學方程式為___。
(2)實驗過程中,裝置乙、丙中出現(xiàn)的現(xiàn)象分別是__________、____________;裝置丙中的試管內(nèi)發(fā)生反應的離子方程式為________________(不是離子反應的不寫)。
(3)取下裝置丙中的試管D,在其中滴加FeSO4溶液,溶液變?yōu)?/span>________色,為了證明鐵元素在該反應中的產(chǎn)物,可以再向溶液中滴加KSCN溶液,溶液變?yōu)?/span>________色。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應2SO2(g)+O2(g)![]() 2SO3(g)從正方向開始,并達到了平衡,此時SO2和O2的物質(zhì)的量之比為2∶1;若采取某種措施,導致SO2和O2又消耗了一些,并再次達到平衡,下列說法正確的是
2SO3(g)從正方向開始,并達到了平衡,此時SO2和O2的物質(zhì)的量之比為2∶1;若采取某種措施,導致SO2和O2又消耗了一些,并再次達到平衡,下列說法正確的是
A. 新平衡體系中,SO2和O2物質(zhì)的量之比仍為2∶1
B. 平衡向正反應方向移動,原因是正反應速率增大,逆反應速率減小
C. 新平衡體系與舊平衡體系比較,SO3的濃度肯定增大
D. 若采取的措施是縮小容器的容積,則新舊平衡中SO2和O2的轉(zhuǎn)化率之比都是1∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿性鋅錳干電池在放電時,電池的總反應方程式可以表示為: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。電池放電時,負極上發(fā)生反應的物質(zhì)是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
【答案】A
【解析】
試題分析:根據(jù)總反應方程式可知Zn在反應中失去電子,發(fā)生氧化反應,所以作原電池的負極,MnO2得到電子,發(fā)生還原反應,作原電池的正極。因此答案是選項A。
考點:考查根據(jù)原電池反應原理確定電池的電極材料的知識
【題型】單選題
【結(jié)束】
17
【題目】在恒容隔熱容器中,下列說法可以證明可逆反應N2+3H2![]() 2NH3已達到平衡狀態(tài)的是( )
2NH3已達到平衡狀態(tài)的是( )
①1mol N≡N鍵斷裂的同時,有6mol N-H鍵斷裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他條件不變時,體系氣體密度不再改變
④NH3、N2、H2的體積分數(shù)都不再改變
⑤體系溫度不再改變
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com