
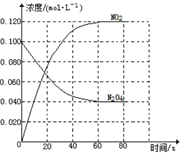
分析 (1)升高溫度平衡向吸熱方向移動;在0~60s時段,△c(NO2)=(0.120-0)mol/L=0.120mol/L,在0~60s時段,反應速率v(NO2)=$\frac{△c}{△t}$;
(2)降低溫度化學反應速率減慢;
這10s內△c(NO2)=0.0020mol/(L.s)×10s=0.02mol/L,
則再次達到平衡狀態時c(NO2)=(0.120-0.02)mol/L=0.1mol/L,
這10s內△c(N2O4)=$\frac{1}{2}$△c(NO2)=$\frac{1}{2}$×0.02mol/L=0.01mol/L,
平衡時c(N2O4)=0.040mol/L+0.01mol/L=0.05mol/L,
化學平衡常數K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;
(3)甲醇燃料堿性電池中,負極上甲醇失電子和氫氧根離子反應生成碳酸根離子和水;用石墨作電極電解氯化鎂溶液時,陽極上氯離子放電生成氯氣,陰極上水得電子生成氫氣和氫氧根離子,氫氧根離子和鎂離子反應生成氫氧化鎂沉淀;
(4)要使溶液不產生沉淀,則溶液中c(OH-)=$\root{3}{\frac{{K}_{sp}}{c(F{e}^{3+})}}$=$\root{3}{\frac{4.0×1{0}^{-38}}{5}}$mol/L=2×10-13mol/L,
溶液中c(H+)=$\frac{1{0}^{-14}}{2×1{0}^{-13}}$mol/L=0.05mol/L,根據氫離子物質的量相等計算鹽酸體積.
解答 解:(1)升高溫度平衡向吸熱方向移動,隨溫度的升高,混合氣體的平均相對分子質量減小,說明平衡正向移動,則焓變小于0;在0~60s時段,△c(NO2)=(0.120-0)mol/L=0.120mol/L,在0~60s時段,反應速率v(NO2)=$\frac{△c}{△t}$=$\frac{0.120mol/L}{60s}$=0.002 mol/(L.s),
故答案為:小于;0.002;
(2)改變溫度二氧化氮反應速率降低,應該是降低溫度,即T小于100℃;
這10s內△c(NO2)=0.0020mol/(L.s)×10s=0.02mol/L,
則再次達到平衡狀態時c(NO2)=(0.120-0.02)mol/L=0.1mol/L,
這10s內△c(N2O4)=$\frac{1}{2}$△c(NO2)=$\frac{1}{2}$×0.02mol/L=0.01mol/L,
平衡時c(N2O4)=0.040mol/L+0.01mol/L=0.05mol/L,
化學平衡常數K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$=$\frac{0.{1}^{2}}{0.05}$=0.2,
故答案為:小于;0.2;
(3)甲醇燃料堿性電池中,負極上甲醇失電子和氫氧根離子反應生成碳酸根離子和水,負極反應式為CH3OH-6e-+8OH-=CO32-+6H2O;用石墨作電極電解氯化鎂溶液時,陽極上氯離子放電生成氯氣,陰極上水得電子生成氫氣和氫氧根離子,氫氧根離子和鎂離子反應生成氫氧化鎂沉淀,所以看到的現象是有無色氣體生成且有白色沉淀生成,
故答案為:CH3OH-6e-+8OH-=CO32-+6H2O;有無色氣體和白色沉淀生成;
(4)要使溶液不產生沉淀,則溶液中c(OH-)=$\root{3}{\frac{{K}_{sp}}{c(F{e}^{3+})}}$=$\root{3}{\frac{4.0×1{0}^{-38}}{5}}$mol/L=2×10-13mol/L,溶液中c(H+)=$\frac{1{0}^{-14}}{2×1{0}^{-13}}$mol/L=0.05mol/L,加入稀鹽酸體積=$\frac{0.05mol/L×0.1L}{2mol/L}$=2.5mL,
故答案為:2.5.
點評 本題考查化學平衡計算、原電池和電解池原理、鹽類水解等知識點,側重考查學生分析計算及知識靈活運用能力,難點是電極反應式的書寫及(4)題計算,注意電解反應式的書寫要結合電解質溶液酸堿性書寫,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑥ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ③④ | C. | ④ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 氯化銀、溴化銀和碘化銀的溶解度依次增大 | |
| B. | 將硫酸銀溶解于水后,向其中加入少量硫化鈉固體,不能得到黑色沉淀 | |
| C. | 在5mL1.5×10-5 mol•L-1的NaCl溶液中,加入1滴(1mL約20滴)1.0×10-3mol•L-1的AgNO3溶液,不能觀察到白色沉淀 | |
| D. | 在燒杯中放入6.24 g 硫酸銀固體,加200 g 水,經充分溶解后,所得飽和溶液的體積為200 mL,溶液中Ag+ 的物質的量濃度為0.2 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液顏色保持不變,說明上述可逆反應達到平衡狀態 | |
| B. | 若用綠礬(FeSO4•7H2O)作還原劑,處理1L廢水,至少需要917.4 g | |
| C. | 常溫下轉化反應的平衡常數K=l×1014.則轉化后所得溶液的pH=6 | |
| D. | 常溫下Ksp[Cr(OH)3]=1×10-32,要使處理后廢水中的c(Cr3+ )降至1×10-5mol/L,應調溶液的pH=5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
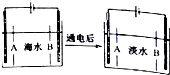 南海諸島是我國固有領土,但多數島上淡水資源匱乏,為檢驗某島上泉水是否達標,取樣品對其進行檢驗:
南海諸島是我國固有領土,但多數島上淡水資源匱乏,為檢驗某島上泉水是否達標,取樣品對其進行檢驗:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 能源、環境與生產生活和社會發展密切相關.
能源、環境與生產生活和社會發展密切相關.| 容 器 | 甲 | 乙 |
| 反應物投入量 | 1molCO 2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡時c(CH3OH) | c1 | c2 |
| 平衡時能量變化 | 放出29.4kJ | 吸收akJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
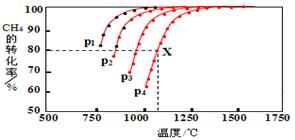
 合成氣(C0+H2)在煤化工和天然氣化工中有著十分重要的地位,由合成氣可合成多種有機基礎原料和產品.
合成氣(C0+H2)在煤化工和天然氣化工中有著十分重要的地位,由合成氣可合成多種有機基礎原料和產品.| 碳氧比[$\frac{n(C{H}_{4})}{n({O}_{2})}$] | 1:0.25 | 1:0.5 | 1:1 | 1:1.25 |
| CH4轉化率 | 0.40 | 0.88 | 0.98 | 0.99 |
| H2選擇性 | 0.98 | 0.93 | 0.67 | 0.40 |
| CO選擇性 | 0.99 | 0.94 | 0.65 | 0.32 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 容器 | 甲 | 乙 | 丙 |
| 反應物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的濃度(mol•L-1) | c1 | c2 | c3 |
| 反應的能量變化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 體系壓強(Pa) | p1 | p2 | p3 |
| 反應物轉化率 | a1 | a2 | a3 |
| A. | α1+α3<1 | B. | a+b>92.4 | C. | 2p2<p3 | D. | 2c1>c3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com