
【題目】研究發現,反應CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g) ,可使CCl4(沸點77 ℃)轉化為重要的化工原料CHCl3(沸點61.2 ℃),可減少其對臭氧層的破壞。(已知:該反應的副反應會生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸點77 ℃)轉化為重要的化工原料CHCl3(沸點61.2 ℃),可減少其對臭氧層的破壞。(已知:該反應的副反應會生成CH2Cl2、CH3Cl和CH4等)
(1)CH4與Cl2反應時,每生成1molCCl4(g)或1molCHCl3(g)的焓變分別是△H1和△H2;H2在Cl2中燃燒,每生成1molHCl(g)產生的焓變為△H3,則:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密閉容器中,CCl4+H2![]() CHCl3+HCl達到平衡狀態后,測得如下數據(假設不考慮副反應)。
CHCl3+HCl達到平衡狀態后,測得如下數據(假設不考慮副反應)。
實驗序號 | 溫度/℃ | 初始CCl4濃度/(mol·L-1) | 初始H2濃度/(mol·L-1) | CCl4的平衡轉化率 |
1 | 110 | 0.8 | 1.2 | α1 |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | α3 |
①實驗1中,CCl4的轉化率α1_____50%(填“大于”“小于”或“等于”)。
②實驗2中,反應進行到10h時達到平衡,在這10h內,H2的平均反應速率為_____mol· L-1·min-1。
③110 ℃時,該反應的化學平衡常數的數值為________。
④實驗3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依題所給信息無法判斷

①圖中表示H2起始濃度為2mol·L-1CHCl3的百分含量的變化曲線是____(填字母)。
②依圖可知,有利于提高CCl4的消耗百分率和產物中CHCl3的百分含量H2的起始濃度應該為________mol·L-1。
【答案】△H2-△H1+2△H3 大于 0.00083 1 D d 4
【解析】
(1)由題意知,CH4(g)+4Cl2(g)= CCl4(g)+4HCl(g) △H1 ①
CH4(g)+3Cl2(g)= CHCl3(g)+3HCl(g) △H2 ②
H2(g)+Cl2(g)=2HCl(g) 2△H3 ③
將②-①+③,即可求出CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H;
CHCl3(g)+HCl(g)的△H;
(2)① 實驗1中,當H2的初始濃度為0.8mol/L時,CCl4的轉化率為50%,現增大H2的濃度為1.2mol,平衡正向移動,CCl4的轉化率增大,從而得出CCl4的轉化率α1與50%的關系;
②實驗2中,
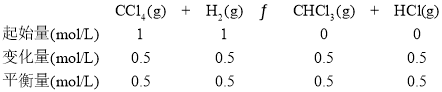
反應進行到10h時達到平衡,在這10h內,H2的平均反應速率為![]() ;
;
③110 ℃時,該反應的化學平衡常數的數值為![]() ;
;
④與實驗2進行比較,可認為實驗3是在實驗2的基礎上完成的,由于不知反應的焓變,所以無法確定降溫平衡移動的方向;
(3)① 由反應知,增大H2的初始濃度,CCl4的消耗百分率增大,CHCl3的百分含量增大,由此可確定圖中表示H2起始濃度為2mol·L-1CHCl3的百分含量的變化曲線;
②依圖可知,H2濃度越大,越有利于提高CCl4的消耗百分率和產物中CHCl3的百分含量,由此可得出H2的起始濃度。
(1)由題意知,CH4(g)+4Cl2(g)= CCl4(g)+4HCl(g) △H1 ①
CH4(g)+3Cl2(g)= CHCl3(g)+3HCl(g) △H2 ②
H2(g)+Cl2(g)=2HCl(g) 2△H3 ③
將②-①+③,即可求出CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=△H2-△H1+2△H3;
CHCl3(g)+HCl(g)的△H=△H2-△H1+2△H3;
(2)① 實驗1中,當H2的初始濃度為0.8mol/L時,CCl4的轉化率為50%,現增大H2的濃度為1.2mol,平衡正向移動,CCl4的轉化率增大,從而得出CCl4的轉化率α1大于50%;
②實驗2中,
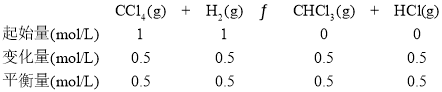
反應進行到10h時達到平衡,在這10h內,H2的平均反應速率為![]() =0.00083mol· L-1·min-1;
=0.00083mol· L-1·min-1;
③110 ℃時,該反應的化學平衡常數的數值為![]() =1;
=1;
④與實驗2進行比較,可認為實驗3是在實驗2的基礎上完成的,由于不知反應的焓變,所以無法確定降溫平衡移動的方向,答案為:D;
(3)① 由反應知,減小H2的初始濃度,CCl4的消耗百分率減小,CHCl3的百分含量減小,由此可確定圖中表示H2起始濃度為2mol·L-1時CHCl3的百分含量的變化曲線為d;
②依圖可知,H2濃度越大,越有利于提高CCl4的消耗百分率和產物中CHCl3的百分含量,由此可得出H2的起始濃度為4mol·L-1。


科目:高中化學 來源: 題型:
【題目】對于化學方程式SiO2+3C![]() SiC+2CO↑,有關敘述正確的是
SiC+2CO↑,有關敘述正確的是
A. 反應中SiO2是氧化劑,C是還原劑
B. 硅元素被還原了,碳元素被氧化了
C. 在反應中C既是氧化劑又是還原劑
D. 在反應中氧化劑與還原劑的物質的量之比為1∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組在實驗室用乙醇、濃硫酸和溴化鈉和水混合反應來制備溴乙烷,并探究溴乙烷的性質。有關數據見下表:
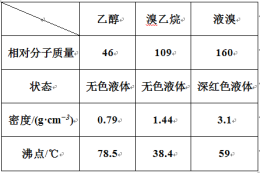
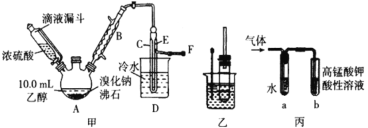
I. 溴乙烷的制備
反應原理如下,實驗裝置如上圖(加熱裝置、夾持裝置均省略):
H2SO4+NaBr ![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
(1) 圖甲中A 儀器的名稱_____,圖中B 冷凝管的作用為_____。
(2) 若圖甲中A 加熱溫度過高或濃硫酸的濃度過大,均會使 C 中收集到的粗產品呈橙色,原因是A 中發生了副反應生成了_____;F 連接導管通入稀NaOH 溶液中,其目的主要是吸收_____等尾氣防止污染空氣
II. 溴乙烷性質的探究
用如圖實驗裝置驗證溴乙烷的性質:
(3) 在乙中試管內加入 10mL6mol·L -1NaOH 溶液和 2mL 溴乙烷,振蕩、靜置,液體分層,水浴加熱。該過程中的化學方程式為_______。
(4) 若將乙中試管里的 NaOH 溶液換成NaOH 乙醇溶液,為證明產物為乙烯,將生成的氣體通入如圖丙裝置。a 試管中的水的作用是_______;若無 a 試管,將生成的氣體直接通入 b 試管中,則 b中的試劑可以為 _____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】波立維是國家剛剛引進的新藥,它給中風、心肌梗死等心臟病患者帶來福音。波立維屬于硫酸氫鹽,它的結構如圖所示。下列關于它的說法正確的是()
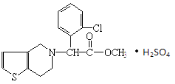
A.該物質的化學式為C16H15ClNO2·H2SO4
B.1mol該物質最多可與6mol氫氣反應
C.波立維能形成硫酸氫鹽是與其結構中的氮原子有關
D.該有機物可以發生氧化、還原、加成、取代、消去反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關電解質溶液的說法正確的是
A.向0.1mol![]() CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中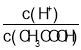 減小
減小
B.將CH3COONa溶液從20℃升溫至30℃,溶液中![]() 增大
增大
C.向鹽酸中加入氨水至中性,溶液中![]() >1
>1
D.將0.1mol/L的NaOH的溫度提高至80℃,溶液的pH變小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列文字表述與反應方程式對應且正確的是( )
A.氧化鐵溶于氫碘酸:Fe2O3+6H+===2Fe3++3H2O
B.含等物質的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C.向氯化鋁溶液中加入過量氨水:Al3++4NH3·H2O=== AlO2-+4NH4++2H2O
D.向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O![]() CaSO3↓+2HClO
CaSO3↓+2HClO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】早期發現的一種天然二十面體準晶顆粒由Al、Ca、Cu、Fe四種金屬元素組成。請回答下列問題:
(1)基態鐵原子價電子排布式為_________,從結構角度來看,Fe2+易被氧化成Fe3+的原因是________________。
(2)SCN-離子可用于 Fe3+的檢驗,其對應的酸有兩種,分別為硫氰酸(H-S-C≡N)和異硫氰酸(H-N=C=S)。
①寫出與 SCN-互為等電子體的一種微粒_____(分子或離子);
②硫氰酸分子中硫原子的雜化方式為_____。
③異硫氰酸的沸點比硫氰酸沸點高的原因是____________________________。
(3)新制的Cu(OH)2可溶于過量的氨水,生成的配合物[Cu(NH3)4](OH)2中含有的化學鍵類型有 _____________________,1 mol該物質中含有 ____________________個σ鍵。
(4)CaF2晶體的晶胞如圖所示。已知:CaF2晶體的密度為ρ g·cm-3,NA代表阿伏加德羅常數的值。CaF2晶體中Ca2+和F-之間的最近核間距(d)為 ______________pm(列出計算式即可)。
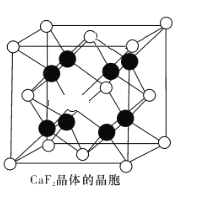
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CCTV在“新聞30分”中介紹:王者歸“錸”,我國發現超級錸礦,飛機上天全靠它。錸的穩定硫化物有ReS2,穩定的氧化物有Re2O7。工業上,常從冶煉銅的廢液中提取錸,其簡易工藝流程如下(部分副產物省略,錸在廢液中以ReO4-形式存在):
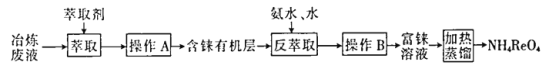
回答下列問題:
(1)NH4ReO4(高錸酸銨)中錸元素化合價為_________________。
(2)操作A的名稱是_____________。
“萃取”中萃取劑應具有的性質:______(填代號)。
①萃取劑難溶于水 ②萃取劑的密度大于水
③ReO4-在萃取劑中的溶解度大于在水中的溶解度 ④萃取劑不和ReO4-發生反應
(3)在“反萃取”中,加入氨水、水的目的是_________________。
(4)在高溫下高錸酸銨分解生成Re2O7,用氫氣還原Re2O7,制備高純度錸粉。
①寫出高錸酸銨分解生成Re2O7的化學方程式_____________________。
②工業上,利用氫氣還原Re2O7制備錸,根據生成錸的量計算氫氣量,實際消耗H2量大于理論計算量,其原因是_____________________。
(5)工業上,高溫灼燒含ReS2的礦粉,可以制備R2O7。以含ReS2的礦石原料生產48.4tRe2O7,理論上轉移__________mol電子。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、X、Y、Z、Q、R、T 分別代表原子序數依次增大的短周期元素。元素A是原子半徑最小的元素;X、Y、Z同周期且相鄰,都是蛋白質的組成元素;X、R同族,Q與T原子的最外層電子數之和是R原子最外層電子數的2倍,T單質為淡黃色固體。U是d區元素,U2+的核外最高能級有2對成對電子。請回答下列問題:
(1)Y元素在周期表中的位置______,位于周期表______區;Q原子的核外電子排布式為______。
(2)X、Y、Z元素的第一電離能由大到小的順序是______。
(3)TZ3分子為______分子(填“極性”或“非極性”),YZ2–離子實際構型是______。
(4)Z和T的簡單氣態氫化物穩定性好的是______(填化學式),原因是______。
(5)A、X、Z可形成分子式為A2XZ的有機物,則該化合物分子中X原子的軌道雜化類型是______;1mol該分子中含有π鍵的數目是______。(用“NA”表示)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com