
(10分)試回答下列各問題:
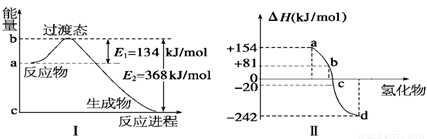
(1)如圖Ⅰ所示是1 mol NO2和CO反應生成 CO2和NO過程中能量變化示意圖,請寫出NO2和CO反應的熱化學方程式: 。
(2)化學反應的焓變與反應物和生成物的鍵能有關。
①已知:H2(g)+Cl2(g) === 2HCl(g) ΔH=-185 kJ/mol;
鍵能ΔH298(H—H)=436 kJ/mol,ΔH298(Cl—Cl)=247 kJ/mol,則ΔH298(H—Cl)= 。
②圖Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲生成氫化物時的焓變數據,根據這組焓變數據可確定a、b、c、d分別代表的元素,試寫出硒化氫發生分解反應的熱化學方程式: 。
(3)已知: ①Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g) ΔH=-a
kJ/mol
2Fe(s)+3CO2(g) ΔH=-a
kJ/mol
②3Fe2O3(s)+CO(g)
 2Fe3O4(s)+CO2(g)
ΔH=-b kJ/mol
2Fe3O4(s)+CO2(g)
ΔH=-b kJ/mol
③Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g) ΔH=+ckJ/mol
3FeO(s)+CO2(g) ΔH=+ckJ/mol
則FeO(s) +CO(g)  Fe(s)+CO2(g) ΔH=-
。
Fe(s)+CO2(g) ΔH=-
。
(1)NO2(g)+CO(g) === NO(g)+CO2(g) ΔH=-234 kJ/mol
(2)①434 kJ/mol。②H2Se(g) === Se(s)+H2(g) ΔH=-81 kJ/mol
(3) ΔH= - 1/6(3a-b+2c)kJ/mol
【解析】(1)根據圖Ⅰ可知反應物的總能量高于生成物的總能量,是放熱反應,放出的熱量是368kJ/-134 kJ=234 kJ,所以熱化學方程式為NO2(g)+CO(g) === NO(g)+CO2(g) ΔH=-234 kJ/mol。
(2)②反應熱就是斷鍵吸收的能量和形成化學鍵所放出的能量的差值,因此ΔH==436 kJ/mol+247 kJ/mo-2X=-185 kJ/mo,解得X=434 kJ/mol。
①非金屬性越強,和氫氣化合越劇烈,放出的熱量就越多。所以a、b、c、d分別代表的元素是碲、硒(Se) 、硫、氧。生成硒化氫的反應是吸熱反應,則逆反應就是放熱反應,所以硒化氫發生分解反應的熱化學方程H2Se(g) === Se(s)+H2(g) ΔH=-81 kJ/mol。
(3)根據蓋斯定律可知,①×3-②-③×2即得到6FeO(s) +6CO(g)  6Fe(s)+6CO2(g),所以反應熱為ΔH= -(3a-b+2c)kJ/mol。
6Fe(s)+6CO2(g),所以反應熱為ΔH= -(3a-b+2c)kJ/mol。


 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
有短周期A、B、C、D、E五種元素,它們的原子序數由A至E漸大。D的氫化物的分子式為H2D,D的最高價氧化物中D的質量分數為40%,且D原子的原子核中質子數和中子數相等。A原子最外電子層上有4個電子。B的陰離子與C的陽離子和氖原子的電子層結構相同。E原子的M電子層上共有7個電子。常溫常壓下,B單質是氣體,已知0.1mol的B單質與1.204×1023個H2完全反應。C單質在加熱條件下與B單質反應生成淡黃色固體。根據上述情況,試回答下列各問題。
(1)A~E的元素符號分別為______、______、______、______、______。
(2)C單質和B單質在加熱條件下生成化合物A2B2,寫出反應的化學方程式:
_______________________________________;
寫出A2B2與A的氧化物反應的化學方程式:
_______________________________________。
(3)試寫出D、E最高價氧化物水化物分子式_________,_________,并比較酸性強弱________________;寫出D、E氣態氫化物分子式___________、___________,比較它們的穩定性________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
(8分)在某溫度時,把 0.5mol N2O4 氣體通入體積為5L的密閉容器中,2s時NO2的濃度為0.02mol.L-1,60s時達到平衡,此時容器內的壓強為開始時的1.6倍。試回答下列各問題:
(1)2s時用N2O4濃度變化表示的化學反應速率是_________________。
(2)2s時,體系內的壓強為開始時的 ________倍,此時N2O4的分解率為_______。
(3)達到平衡時,平衡混合物中N2O4的物質的量為____________,
查看答案和解析>>
科目:高中化學 來源:2010年江蘇省高一下學期期末考試化學試題 題型:填空題
(18分)有A、B、C、D、E、F六種短周期元素,原子序數依次增大,B、C、D的陽離子、A的陰離子均具有與氖原子相同的電子層結構;A、B可形成離子化合物B2A;D的最高價氧化物既能與強酸反應,又能與強堿反應;E的原子結構示意圖為: ;F的最外層電子數是電子層數的2倍。
;F的最外層電子數是電子層數的2倍。
試回答下列各問題:
(1)B元素為 (填元素符號)
(2)F元素位于元素周期表中第 周期第 族
(3)化合物B2A的電子式____________________
(4)D的最高價氧化物與B的最高價氧化物對應的水化物溶液反應的離子方程式:
(5)將C、D用導線相連浸入B的最高價氧化物對應的水化物的溶液中,形成原電池,正極的電極反應為
查看答案和解析>>
科目:高中化學 來源:2012屆貴州省高二上學期期末考試化學試卷 題型:填空題
(8分)在某溫度時,把 0.5mol N2O4 氣體通入體積為5L的密閉容器中,2s時NO2的濃度為0.02mol.L-1,60s時達到平衡,此時容器內的壓強為開始時的1.6倍。試回答下列各問題:
(1)2s時用N2O4濃度變化表示的化學反應速率是_________________。
(2)2s時,體系內的壓強為開始時的 ________倍,此時N2O4的分解率為_______。
(3)達到平衡時,平衡混合物中N2O4的物質的量為____________,
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com