
【題目】下圖為Zn-Cu原電池的示意圖,請回答:
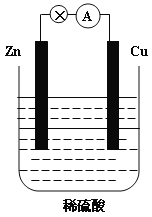
(1)鋅片為原電池的______________(填“正”或“負”)極,該極的電極反應式是___________。該反應屬于_______________(填“氧化”或“還原”)反應。
(2)__________(填“電子”或“電流”)從鋅片通過導線流向銅片,溶液中H+的從_________(填“鋅片”或“銅片”)獲得電子。
(3)原電池工作一段時間后,H2SO4溶液的濃度_________(填“增大”或“減小”,下同),燒杯中溶液的質量__________。
(4)若鋅片質量減輕6.5g,則另一極放出氣體的體積為_________L(標準狀況)。
【答案】負 Zn – 2e-= Zn2+ 氧化 電子 銅片 減小 增大 2.24
【解析】
(1)鋅比銅活潑,鋅片為原電池的負極,Zn發生氧化反應,電極反應式為Zn-2e-=Zn2+;故答案為負;Zn-2e-=Zn2+;氧化;
(2)原電池工作時,電子從鋅片(負極)通過導線流向銅片(正極),銅為原電池的正極,發生還原反應,電極反應式為2H++2e-=H2↑,溶液中H+的從銅片獲得電子;故答案為電子;銅片;
(3)電池總反應為Zn+2H+=Zn2++H2↑,由反應的方程式可知,原電池工作一段時間后,H2SO4溶液的濃度變小,溶液中每消耗2gH+,同時生成65gZn2+,燒杯中溶液質量增大;故答案為減小;增大;
(4)若鋅片質量減輕6.5g,n(Zn)=6.5g÷65g/mol=0.1mol,根據電池總反應Zn+2H+=Zn2++H2↑,生成氫氣物質的量為0.1mol,標準狀況下體積為0.1mol×22.4L/mol=2.24L;故答案為2.24。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】有機物烴A、B和C的結構如下圖,下列有關說法正確的是
A. A的二氯代物結構有兩種
B. B的分子式為![]()
C. 與C互為同分異構體且屬于芳香烴的有機物可能使酸性高錳酸鉀溶液褪色
D. A、B、C中只有C的最簡式為CH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗現象預測正確的是
A | B | C | D |
|
|
|
|
燒杯中產生白色沉淀,一段時間后沉淀無明顯變化 | 加鹽酸出現白色渾濁,加熱變澄清 | KMnO4 酸性溶液在苯和甲苯中均褪色 | 液體分層,下層呈 無色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質A~K有如圖的轉化關系,其中D、E為氣體單質,A、H為常見金屬。試回答(圖中有些反應的產物和反應的條件沒有全部標出):
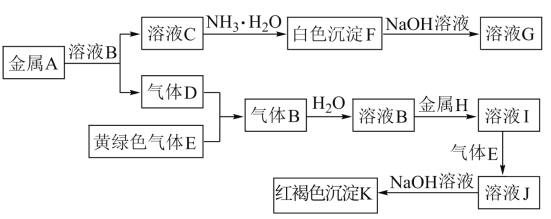
(1)寫出下列物質的化學式:D是________, I是______。
(2)寫出“C→F”反應的離子方程式:______________________________________。
(3)寫出反應“J→K”的離子方程式:____________________________________。
(4)在溶液I中滴入NaOH溶液,可觀察到的現象是______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在標準狀況下,三個干燥的燒瓶內分別裝入:干燥純凈的氨氣、含有部分空氣的氯化氫氣體、體積比為4∶1的二氧化氮與氧氣的混合氣體。分別做噴泉實驗,最終三個燒瓶中所得溶液的物質的量濃度(假設溶液不外滲)之比為( )
A.2∶1∶2B.5∶5∶4C.1∶1∶1D.無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數的值。下列說法正確的是
A.標準狀況下,22.4 L苯含有的分子數約為NA
B.密閉容器中23 g NO2與N2O4的混合氣體中氮原子數為0.5NA
C.1 L 0.1 mol·L-1的NaHCO3溶液中,HCO3- 和CO32- 離子數之和為0.1NA
D.密閉容器中1 mol N2(g)與3 mol H2 (g)反應制備氨氣,形成6NA個N-H鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鉀(K2FeO4)是一種環保、高效、多功能飲用水處理劑,制備流程如圖所示:
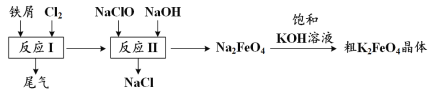
下列敘述不正確的是
A.用K2FeO4對飲用水殺菌消毒的同時,還產生Fe(OH)3膠體吸附雜質凈化水
B.用FeCl2溶液吸收反應I中尾氣后可再利用
C.反應II中氧化劑與還原劑的物質的量之比為3∶2
D.該生產條件下,物質的溶解性:Na2FeO4< K2FeO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用元素的化合價推測物質的性質是化學研究的重要手段。如圖是硫元素的常見化合價與部分物質類別的對應關系:

(1)從硫元素化合價變化的角度分析,圖中既有氧化性又有還原性的化合物有_______________(填化學式)。
(2)將X與Y混合,可生成淡黃色固體。該反應中氧化劑與還原劑的物質的量之比為_____________。
(3)檢驗物質Y的方法是______________________________。
(4)Z的濃溶液與銅單質在一定條件下可以發生化學反應,該反應的化學方程式為____________。
(5)Na2S2O3是重要的化工原料,從氧化還原反應的角度分析,下列制備Na2S2O3的方案理論上可行的是_____________(填字母)。
a.Na2S+S b.Na2SO3+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr2O7氧化為Na2SO4,則24mL 0.05mol·L-1的Na2SO3溶液與 20mL 0.02mol·L-1的K2Cr2O7溶液恰好反應時,Cr元素在還原產物中的化合價為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組以電路板刻蝕液(含有大量Cu2+、Fe2+、Fe3+)為原料制備納米Cu20,制備流程如下:
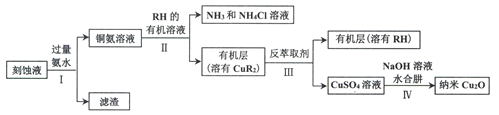
已知:①Cu2O在潮濕的空氣中會慢慢氧化生成CuO,也易被還原為Cu; Cu2O不溶于水,極易溶于堿性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反應:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
請回答:
(1)步驟II,寫出生成CuR2反應的離子方程式:____________________________
(2)步驟II,需對水層多次萃取并合并萃取液的目的是___________________________
(3)步驟III,反萃取劑為_____________
(4)步驟IV,①制備納米Cu2O時,控制溶液的pH為5的原因是_______________
A. 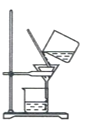 B.
B. 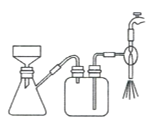 C.
C. 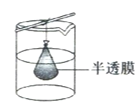
②從溶液中分離出納米Cu2O采用離心法,下列方法也可分離Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)為測定產品中Cu2O的含量,稱取3.960g產品于錐形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反應后用0.2000 mol·L-1標準KMnO4溶液滴定,重復2~3次,平均消耗KMnO4溶液50.00mL。
①產品中Cu2O的質量分數為_______
②若無操作誤差,測定結果總是偏高的原因是_____
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com