
【題目】已知NO2和N2O4可以相互轉化:2NO2(g)N2O4(g)(正反應為放熱反應).現將一定量NO2和N2O4的混合氣體通入一體積為2L的恒溫密閉容器中,反應物物質的量隨時間變化關系如圖所示,則下列說法錯誤的是( ) 
A.前10min內用NO2表示的化學反應速率v(NO2)=0.02mol/(Lmin)
B.反應進行至25min時,曲線發生變化的原因可以是向容器中添加NO2(g)
C.若要達到與最后相同的化學平衡狀態,在25min時還可以采取的措施是添加N2O4(g)
D.a、b、c、d四個點中,表示化學反應處于平衡狀態的點成是b和d
【答案】A
【解析】解:由圖可知0﹣10min平衡狀態時,X曲線△c=(0.6﹣0.2)mol/L=0.4mol/L,Y曲線△c=(0.6﹣0.4)mol/L=0.2mol/L,X曲線濃度變化量是Y曲線濃度變化量的2倍,則X曲線表示NO2濃度隨時間的變化曲線,Y曲線表示N2O4濃度隨時間的變化曲線;反應時NO2濃度增大,N2O4濃度減小,說明反應逆向進行; A.前10min內用NO2表示的化學反應速率v(NO2)= ![]() =
= ![]() =0.04mol/(Lmin),故A錯誤;
=0.04mol/(Lmin),故A錯誤;
B.反應進行至25min時,c(NO2)增大、c(N2O4)不變,所以改變的條件可能是向容器中添加NO2(g),故B正確;
C.若要達到與最后相同的化學平衡狀態,在25min時還可以增大生成物平衡逆向移動來實現,故C正確;
D.如果各物質的濃度不變時,該可逆反應達到平衡狀態,根據圖知,bd點各物質濃度不變,說明正逆反應速率相等,反應達到平衡狀態,故D正確;
故選A.
由圖可知0﹣10min平衡狀態時,X曲線△c=(0.6﹣0.2)mol/L=0.4mol/L,Y曲線△c=(0.6﹣0.4)mol/L=0.2mol/L,X曲線濃度變化量是Y曲線濃度變化量的2倍,則X曲線表示NO2濃度隨時間的變化曲線,Y曲線表示N2O4濃度隨時間的變化曲線;反應時NO2濃度增大,N2O4濃度減小,說明反應逆向進行;
A.前10min內用NO2表示的化學反應速率v(NO2)= ![]() ;
;
B.反應進行至25min時,c(NO2)增大、c(N2O4)不變;
C.若要達到與最后相同的化學平衡狀態,在25min時還可以增大生成物平衡逆向移動;
D.如果各物質的濃度不變時,該可逆反應達到平衡狀態.


 發散思維新課堂系列答案
發散思維新課堂系列答案科目:高中化學 來源: 題型:
【題目】白磷有劇毒,白磷中毒可用硫酸銅溶液解毒,白磷與硫酸銅可以發生如下兩個反應:
(1)2P+5CuSO4+8H2O![]() 5Cu+2H3PO4+5H2SO4
5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4+24H2O![]() 5Cu3P+6H3PO4+15H2SO4
5Cu3P+6H3PO4+15H2SO4
下列有關說法中錯誤的是
A. 在上述兩個反應中,水既不是氧化劑也不是還原劑
B. 在上述兩個反應中,氧化產物都是H3PO4
C. 在反應(2)中,當有5molCuSO4發生反應時,共轉移10mol電子
D. 在上述兩個反應中,氧化劑都只有硫酸銅
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關下列圖象說法錯誤的是( )
A. 圖陰影部分面積表示反應物濃度的凈減少量M
圖陰影部分面積表示反應物濃度的凈減少量M
B.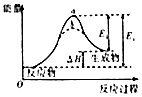 圖虛線b表示反應加入催化劑后能量變化曲線
圖虛線b表示反應加入催化劑后能量變化曲線
C. 圖為可逆反應的濃度一時間圖,化學方程式為2X(g)+3Y(g)2Z(g)
圖為可逆反應的濃度一時間圖,化學方程式為2X(g)+3Y(g)2Z(g)
D. 圖對應于反應H2(g)+CO2(g)H2O(g)+CO(g),曲線I變為曲線II和曲線III改變的條件分別是加入催化劑和將容器的體積快速壓縮為原來的
圖對應于反應H2(g)+CO2(g)H2O(g)+CO(g),曲線I變為曲線II和曲線III改變的條件分別是加入催化劑和將容器的體積快速壓縮為原來的 ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】錫及其化合物在生產、生活中有著重要的用途.已知:Sn的熔點為231℃;Sn2+易水解、易被氧化;SnCl4極易水解、熔點為﹣33℃、沸點為114℃.請按要求回答下列相關問題:
(1)元素錫比同主族碳的周期數大3,錫的原子序數為 .
(2)用于微電子器件生產的錫粉純度測定:①取1.19g試樣溶于稀硫酸中(雜質不參與反應),使Sn完全轉化為Sn2+;②加入過量的Fe2(SO4)3;③用0.1000mol/L K2Cr2O7溶液滴定(產物中Cr呈+3價),消耗20.00mL.步驟②中加入Fe2(SO4)3的作用是;此錫粉樣品中錫的質量分數: .
(3)用于鍍錫工業的硫酸亞錫(SnSO4)的制備路線如下: 
①步驟Ⅰ加入Sn粉的作用:及調節溶液pH.
②步驟Ⅱ用到的玻璃儀器有燒杯、、 .
③步驟Ⅲ生成SnO的離子方程式: .
④步驟Ⅳ中檢驗SnO是否洗滌干凈的操作是 , 證明已洗凈.
⑤步驟Ⅴ操作依次為、、過濾、洗滌、低溫干燥.
(4)SnCl4蒸氣遇氨及水汽呈濃煙狀,因而可制作煙幕彈,其反應的化學方程式為 .
實驗室欲用下圖裝置制備少量SnCl4(夾持裝置略),該裝置存在明顯缺陷,改進方法是 . 
利用改進后的裝置進行實驗,當開始裝置C中收集到有SnCl4時即可熄滅B處酒精燈,反應仍可持續進行的理由是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有①乙酸乙酯和乙酸鈉溶液、②溴化鈉溶液和溴水的混合液,分離它們的正確方法依次是( )
A. 分液、蒸餾B. 分液、萃取C. 萃取、分液D. 蒸餾、分液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】立方烷( ![]() )具有高度對稱性、高致密性、高張力能及高穩定性等特點,因此合成立方烷及其衍生物成為化學界關注的熱點.下面是立方烷衍生物I的一種合成路線:
)具有高度對稱性、高致密性、高張力能及高穩定性等特點,因此合成立方烷及其衍生物成為化學界關注的熱點.下面是立方烷衍生物I的一種合成路線: 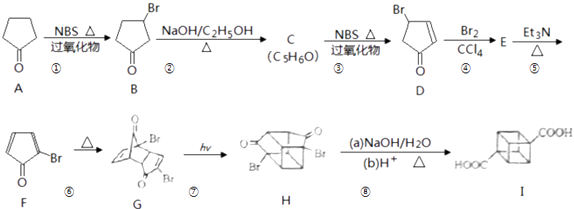
回答下列問題:
(1)C的結構簡式為 , E的結構簡式為 .
(2)③的反應類型為 , ⑤的反應類型為 .
(3)化合物A可由環戊烷經三步反應合成: ![]()
反應I的試劑與條件為 , 反應2的化學方程式為 , 反應3可用的試劑為 .
(4)在I的合成路線中,互為同分異構體的化合物是 . (填化合物代號)
(5)I與堿石灰共熱可化為立方烷.立方烷的核磁共振氫譜中有個峰.
(6)立方烷經硝化可得到六硝基立方烷,其可能的結構有種.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】學習小組擬通過實驗,探究Mg(NO3)2受熱分解的產物.
小組猜想:ⅰ.固體產物可能有Mg(NO2)2、MgO、Mg3N2中的一種或幾種
ⅱ.氣體產物可能有NO2、N2、O2中的一種或幾種
查得相關資料:a.Mg(NO2)2、Mg(NO3)2易溶于水,MgO難溶于水.
b.2NO2+2NaOH═NaNO3+NaNO2+H2O
c.Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑
針對以上猜想,設計了如圖所示實驗(圖中加熱、夾持儀器等裝置均省略):
進行實驗
Ⅰ.檢驗上述裝置氣密性.
Ⅱ.稱取3.7gMg(NO3)2固體,置入硬質玻璃管A中,打開K,通入一段時間N2 , 并進行相關物質質量稱量
Ⅲ.關閉K,用酒精燈持續給裝置A加熱,過程中各裝置內溶液均未倒吸入其它裝置.
Ⅳ.待Mg(NO3)2完全分解,裝置冷卻至室溫,打開K,再緩慢通入一會N2后并再稱量.稱得A中剩余固體質量為1.0g,B、C、D、E、F中溶液質量分別增加了2.3g、0.0g、0.1g、0.3g、0.05g.
Ⅴ.取少量剩余固體于試管中,加入適量水,未出現明顯現象.
回答問題
①小組預測一定有O2生成,理由是 .
②N2的電子式是 , 步驟Ⅱ中,通入一段時間N2的目的是 .
③步驟Ⅲ中,裝置A內若出現了紅棕色氣體,其化學式是 .
④裝置C中若紅色始終未褪,其設計的目的是 .
⑤實驗中發現Mg(NO3)2分解時有O2生成,其實驗現象是 , 用化學用語解釋產生上述現象的原因是 .
⑥實驗中Mg(NO3)2分解沒有N2生成的理由是 .
⑦Mg(NO3)2分解的化學方程式是 .
⑧裝置F中溶液質量增加的原因是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將三份1mol X氣體和3mol Y氣體分別充入體積為2L的A,B,C三個容器中,發生反應X(g)+3Y(g)2Z(g).2min后反應達到平衡,測得A中剩余0.4mol X,B中Y的平衡濃度為0.5mol/L,C中用Z表示的反應速率為:v(Z)=0.3mol/(Lmin),則這段時間內三個容器中反應速率的大小關系為( )
A.B>A>C
B.A>B=C
C.B>A=C
D.B>C>A
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com