
| 滴定次數(shù) | 待測液體積(mL) | 標準鹽酸體積(mL) | |
| 滴定前讀數(shù)(mL) | 滴定后讀數(shù)(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
分析 (1)根據(jù)實驗操作的步驟以及每步操作需要儀器確定反應所需儀器來解答;
(2)根據(jù)堿性溶液盛放在堿式滴定管中;
(3)根據(jù)溶液顏色變化且半分鐘內不變色,可說明達到滴定終點;
(4)滴定過程中溶液從堿性溶液向中性過渡,溶液里的溶質從NaOH到NaCl、NaOH過渡,最后呈中性是溶質為NaCl,但溶液始終顯中性,存在電荷守恒式:c(Na+)+c(H+)=c(OH-)+c(Cl-),據(jù)此分析判斷;
(5)先分析所耗鹽酸標準液的體積的有效性,然后求出所耗鹽酸標準液的體積平均值,然后根據(jù)關系式HCl~NaOH來解答.
(6)根據(jù)c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析不當操作對V(標準)的影響,以此判斷濃度的誤差.
解答 解:(1)配制步驟有計算、稱量、溶解、冷卻、移液、洗滌、定容、搖勻等操作,一般用托盤天平稱量,用藥匙取用藥品,在燒杯中溶解(可用量筒量取),冷卻后轉移到250mL容量瓶中,并用玻璃棒引流,當加水至液面距離刻度線1~2cm時,改用膠頭滴管滴加,所以試驗除了需要250mL容量瓶、量筒、燒杯、膠頭滴管外,還有一種必須使用的儀器是玻璃棒;
故答案為:玻璃棒;
(2)燒堿顯堿性,故需要用堿式滴定管量取燒堿溶液,故答案為:堿;
(3)滴定前溶液為紅色,滴定終點時溶液為無色,所以滴定終點現(xiàn)象為滴最后一滴溶液由紅色變?yōu)闊o色,半分鐘不褪色;
故答案為:當?shù)稳胱詈笠坏嘻}酸,溶液由紅色變?yōu)闊o色,且半分鐘內不褪色;
(4)A.若c(Na+)>c(Cl-)>c(H+)>c(OH-)成立,則c(Na+)+c(H+)>c(Cl-)+c(OH-),明顯與溶液里存在的電荷守恒式不吻合,故A錯誤;
B.在NaOH溶液只滴加幾滴稀鹽酸,此時溶液只生成少量NaCl,應該存在:c(Na+)>c(OH-)>c(Cl-)>c(H+),故B正確;
C.溶液始終顯中性,存在電荷守恒式:c(Na+)+c(H+)=c(OH-)+c(Cl-),故C正確;
D.c(Na+)+c(H+)>c(OH-)+c(Cl-)與溶液里存在的電荷式c(Na+)+c(H+)=c(OH-)+c(Cl-)不符,故D錯誤;
故選BC;
(5)所耗鹽酸標準液的體積分別為:19.90mL,20.10mL,兩組數(shù)據(jù)均有效,鹽酸標準液的平均體積為20.00mL;
HCl~NaOH
1 1
0.2000mol/L×20.00mL C(NaOH)×10mL
解得:C(NaOH)=0.4mol/L,則250mL的溶液中含有NaOH的質量為:0.4mol/L×0.25L×40g/mol=4.0g,燒堿樣品的純度為$\frac{4.0g}{4.3g}$×100%=93%;
故答案為:0.40;93;
(6)A.滴定前平視,滴定后俯視,造成V(標準)偏小,根據(jù)c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析,可知c(待測)偏小,燒堿純度偏小,故A錯誤;
B.未用標準液潤洗滴定管,標準液濃度減小,造成V(標準)偏大,根據(jù)c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析,可知c(待測)偏大,燒堿純度偏大,
故B正確;
C.用待測液潤洗錐形瓶,待測液的物質的量偏大,造成V(標準)偏大,根據(jù)c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析,可知c(待測)偏大,燒堿純度偏大,故C正確;
D.不小心將標準液滴在錐形瓶外面,造成V(標準)偏大,根據(jù)c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析,可知c(待測)偏大,燒堿純度偏大,故D正確;
E.滴定接近終點時,用少量蒸餾水沖洗錐形瓶內壁,待測液的物質的量不變,對V(標準)無影響,可知c(待測)不變,燒堿純度不變,故E錯誤;
故選BCD.
點評 本題主要考查了酸堿中和滴定實驗操作、計算與誤差分析以及滴定過程中溶液里離子濃度大小比較,難度不大,能準確寫出溶液里的電荷守恒式是解答關鍵,結合所學知識即可完成.


科目:高中化學 來源: 題型:選擇題
| A. | “NO2球”浸泡在冷水中,顏色變淺:2 NO2(g)?N2O4(g)△H<0 | |
| B. | 在反應FeCl3+3KSCN?Fe(SCN)3+3KCl 達平衡后,加入少量KCl固體,平衡逆向移動 | |
| C. | 在兩支盛有雙氧水的試管中,一支加入FeCl3溶液,反應明顯加快,而另一支中加入CuSO4溶液,反應加快但不明顯,說明催化劑具有較強選擇性 | |
| D. | 用MnO2做催化劑,催化雙氧水的分解,是因為MnO2可降低該反應活化能,提高活化分子的百分數(shù) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 屬于同種元素 | B. | 屬于同位素 | C. | 屬于同種核素 | D. | 屬于同種原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
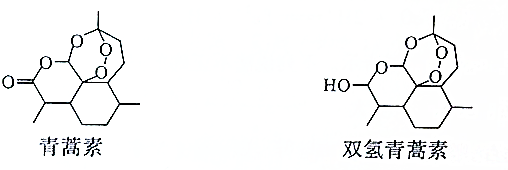
| A. | 雙氫青篙素屬于脂類物質 | |
| B. | 青蒿素的分子式為C15H21O5 | |
| C. | 青蒿素環(huán)上的一氯取代物有11種 | |
| D. | 青蒿素通過加成反應可以轉化為雙氫青蒿素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙醇制乙醛、乙酸制乙酸乙酯均為取代反應 | |
| B. | 乙烯制聚乙烯、苯制硝基苯均發(fā)生加聚反應 | |
| C. | 蛋白質鹽析、糖類水解均為化學變化 | |
| D. | 石油分餾、煤干餾均可得到烴 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 25℃時,向20mL 0.1mol/L的氫氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加過程中混合溶液的pH變化曲線如圖所示,回答下列問題:
25℃時,向20mL 0.1mol/L的氫氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加過程中混合溶液的pH變化曲線如圖所示,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.
CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com