
| A. | 反應中KMnO4被氧化 | |
| B. | 反應中得到電子的物質是Cl2 | |
| C. | 每生成1 mol Cl2時,反應中轉移的電子為2 mol | |
| D. | 被還原的HCl占參加反應HCl物質的量的3/8 |
分析 2KMnO4+16HCl(濃)═2MnCl2+5Cl2↑+2KCl+8H2O中,Mn元素的化合價降低,Cl元素的化合價升高,以此來解答.
解答 解:A.Mn元素的化合價降低,則反應中KMnO4被還原,故A錯誤;
B.Cl元素的化合價升高,則HCl發生氧化反應,氯化氫是失電子的物質,而KMnO4中錳的化合價降低是得電子的物質,故B錯誤;
C.每生成1mol Cl2時,反應中轉移的電子為1mol×2×[0-(-1)]=2 mol,故C正確;
D.2molKMnO4作氧化劑得到電子與10molHCl作還原劑失去電子相同,還有6mol的鹽酸作為酸,所以被還原的HCl占參加反應HCl物質的量的$\frac{10}{16}$=$\frac{5}{8}$,故D錯誤;
故選C.
點評 本題考查氧化還原反應,為高頻考點,把握氧化還原反應中元素的化合價變化及氧化還原反應基本概念為解答的關鍵,側重分析與應用能力的考查,題目難度不大.


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:選擇題
| A. | 氫氣的燃燒熱為△H=-285.5kJ•mol-1,則電解水的熱化學方程式為2H2O(l)$\frac{\underline{\;電解\;}}{\;}$2H2(g)+O2(g)△H=+285.5k•Jmol-1 | |
| B. | 反應SO2(g)+2H2S(g)═3S(s)+2H2O(l)在常溫下能自發進行,則該反應的△H<0 | |
| C. | 500℃、30MPa下,將0.5molN2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g)+3H2(g)═2NH3(g)△H=-38.6k•Jmol-1 | |
| D. | 由C(石墨,s)=C(金剛石,s)△H=+1.90 k•Jmol-1可知,金剛石比石墨穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碘酒是指碘單質的乙醇溶液 | |
| B. | 濃硫酸可以刻蝕石英制藝術品 | |
| C. | 84消毒液的有效成分是NaClO | |
| D. | 氫氧化鋁、小蘇打等可用于治療胃酸過多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
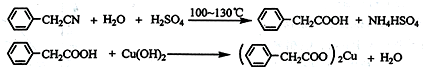
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com