
銅及其化合物在生活、生產中有廣泛應用。請回答下列問題:
(1)自然界地表層原生銅的硫化物經氧化、淋濾作用后變成CuSO4溶液向地下深層滲透,遇到難溶的ZnS,慢慢轉變為銅藍(CuS)。寫出CuSO4轉變為銅藍的離子方程式_______________________________。
(2)工業上以黃銅礦CuFeS2)為原料,采用火法熔煉工藝生產銅的中間過程會發生反應:2Cu2O+Cu2S 6Cu+SO2↑,該反應的氧化劑是_____;驗證反應產生的氣體是SO2的方法是____________。
6Cu+SO2↑,該反應的氧化劑是_____;驗證反應產生的氣體是SO2的方法是____________。
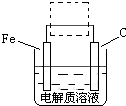
(3)圖I是一種新型燃料電池,它以CO為燃料,一定比例的Li2CO3和Na2CO3熔融混合物為電解質,圖II是粗銅精煉的裝置圖,假若用燃料電池為電源進行粗銅的精煉實驗。
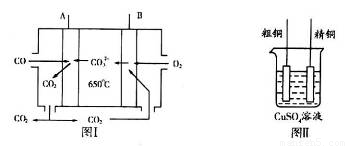
①寫出A極的電極反應式__________________________________________________。
②要用燃料電池為電源進行粗銅的精煉實驗,粗銅板應與__________極(填“A”或“B”)相連;若粗銅中還含有Au、Ag、Fe,它們在電解槽中的存在形式和位置為___________。
③當消耗標準狀況下1.12LCO時,精銅電極的質量變化情況為_________。
(4)現向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根據該實驗可得出的結論是________(填序號)
A.Ksp(CuCO3)<Ksp(CaCO3) B.c(Cu2+)<c(Ca2+)
C.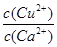 >
>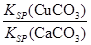 D.
D.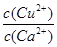 <
<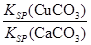
(14分)(1)Cu2+(aq)+ZnS(s)=Zn2+(aq)+CuS(s) (2分)
(2)Cu2O和Cu2S(1分);將氣體通入品紅溶液,溶液褪色,加熱恢復原色(2分)
(3)①CO-2e-+CO32-=2CO2(2分) ②B(1分);Au、Ag以單質的形成沉積在陽極下方,Fe以Fe2+的形式進入電解液中(2分) ③增加3.2g(2分) (4)C(2分)
【解析】
試題分析:(1)硫化銅的溶解度小于氯化鋅的,所以根據沉淀容易向更難溶的方向轉化可知,該反應的離子方程式是Cu2+(aq)+ZnS(s)=Zn2+(aq)+CuS(s)。
(2)根據反應的方程式可知,銅元素的化合價從+1價降低到0價,得到1個電子,S元素的化合價從-2價升高到+4價,失去6個電子,所以Cu2S是還原劑,Cu2O和Cu2S是氧化劑。SO2具有漂白性,能使品紅溶液褪色,據此可以鑒別SO2,所以正確的操作是將氣體通入品紅溶液,溶液褪色,加熱恢復原色。
(3)①原電池中較活潑的金屬是負極,失去電子,發生氧化反應。電子經導線傳遞到正極,所以溶液中的陽離子向正極移動,正極得到電子,發生還原反應。因此CO在負極通入,氧氣在正極通入,即A電極是負極。由于電解質是一定比例的Li2CO3和Na2CO3熔融混合物為電解質,所以CO32-向負極移動,因此負極電極反應式是CO-2e-+CO32-=2CO2。
②粗銅精煉時,粗銅與電源的正極相連,做陽極,即與電極B相連。由于金屬性是Au<Ag<Cu<Fe,所以陽極首先是鐵失去電子,然后是銅失去電子,而Au和Ag形成陽極泥,所以Au、Ag、Fe它們在電解槽中的存在形式和位置為Au、Ag以單質的形成沉積在陽極下方,Fe以Fe2+的形式進入電解液中。
③準狀況下1.12LCO的物質的量是1.12L÷22.4L/mol=0.05mol,反應中轉移電子的物質的量是0.05mol×2=0.1mol,所以根據電荷守恒可知,精銅電極析出銅的物質的量是0.1mol÷2=0.05mol,即陰極精銅增加0.05mol×64g/mol=3.2g。
(4)向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,這說明溶液中c(Cu2+)·c(CO32-)>Ksp(CuCO3)、c(Ca2+)·c(CO32-)<Ksp(CaCO3),所以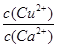 >
>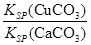 ,因此答案選C。
,因此答案選C。
考點:考查溶解平衡以及沉淀的轉化;氧化還原反應的判斷;SO2的檢驗;電極反應式的書寫以及有關計算;粗銅的精煉等


 中考解讀考點精練系列答案
中考解讀考點精練系列答案科目:高中化學 來源: 題型:
 鐵及其化合物在生活、生產中有廣泛應用.請回答下列問題:
鐵及其化合物在生活、生產中有廣泛應用.請回答下列問題:
| ||


查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| ||
 (FeSO4?7H2O)一起凈水,其原理為
(FeSO4?7H2O)一起凈水,其原理為 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH為
溶液的pH為查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
查看答案和解析>>
科目:高中化學 來源:2011年山東省實驗中學高考化學二模試卷(解析版) 題型:解答題
 6SO2+Fe3O4,氧化產物為______,若有3mol FeS2參加反應,轉移電子的物質的量為______.
6SO2+Fe3O4,氧化產物為______,若有3mol FeS2參加反應,轉移電子的物質的量為______. 一起凈水,其原理為______(用離子方程式表示).
一起凈水,其原理為______(用離子方程式表示). 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH為______(溶液體積變化忽略不計).
溶液的pH為______(溶液體積變化忽略不計).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com