解:(1)A.發生反應為:C+O
2
CO
2,由方程式可知,一方面消耗O
2的體積等于生成CO
2的體積,廣口瓶內液面不會上升,步驟2中就無需調節廣口瓶內外液面相平.另一方面生成的CO
2可以與Mg反應,致使蒸發皿中得到的固體含有MgO.故A錯誤;
B.廢廣口瓶中的氣體為空氣,而鐵在純氧中可以燃燒,在空氣中無法引燃.故B錯誤;
C.紅磷在空氣中燃燒,生成固體五氧化二磷,4P+5O
2
2P
2O
5,除去廣口瓶中的氧氣,導致廣口瓶內壓強減小,液面上升,故C正確;
故答案為:C;
(2)由圖知,無底的廢廣口瓶的底部與水槽底部相接,除去廣口瓶內空氣中的氧氣后,導致廣口瓶內水面上升,廣口瓶外水面就下降,要調節廣口瓶內外液面相平,最直接就是向水槽中加水,故答案為:向水槽中加水;
(3)Mg
3N
2由陽離子Mg
2+和陰離子N
3-組成,溶于足量鹽酸時,可看成先和水反應,生成的產物再和鹽酸反應,
第一步反應Mg
3N
2+6H
2O═3Mg(OH)
2↓+2NH
3↑(H
2O電離出H
+和OH
-,Mg
2+和OH
-結合成Mg(OH)
2,N
3-和H
+結合成NH
3),
第二步Mg(OH)
2和NH
3再與鹽酸反應,生成MgCl
2和NH
4Cl,最后合并得總反應為Mg
3N
2+8HCl=3MgCl
2+2NH
4Cl.
故答案為:Mg
3N
2+8HCl=3MgCl
2+2NH
4Cl;
(4)步驟4中取蒸發皿中得到的固體,加鹽酸溶解.向溶液中加入過量氫氧化鈉溶液,有白色沉淀生成,同時得到一種能使濕潤紅色石蕊試紙變藍的氣體.該氣體為堿性氣體NH
3,說明蒸發皿中得到的固體為Mg
3N
2.如果直接將鎂條在空氣中點燃,空氣中存在N
2、O
2、CO
2,三者都能與鎂反應(N
2+3Mg

Mg
3N
2、O
2+2Mg

2MgO、CO
2+2Mg

2MgO+C),但氧氣比氮氣活潑,氧氣首先與鎂反應生成MgO(與CO
2反應也是生成MgO),進行步驟4中實驗時,無NH
3生成,不能使濕潤紅色石蕊試紙變藍.
故答案為:氧氣比氮氣活潑,與鎂反應生成MgO;
(5)金屬性強弱依據有:①看該金屬與水反應的難易,與水反應越容易,金屬性越強,②看該金屬與酸反應的難易,與酸反應越容易,金屬性越強,③看該金屬最高價氧化物對應水化物的堿性強弱,堿性越強,該金屬金屬性越強,
在MgCl
2溶液和AlCl
3溶液中分別加NaOH 溶液至過量,發生反應MgCl
2+2NaOH═2NaCl+Mg(OH)
2↓、AlCl
3+3NaOH═3NaCl+Al(OH)
3↓、Al(OH)
3+NaOH═NaAlO
2+2H
2O,可見MgCl
2溶液中產生沉淀且不消失,
AlCl
3溶液中產生沉淀后完全溶解.說明Al(OH)
3為兩性氫氧化物,得Mg(OH)
2的堿性強于Al(OH)
3的堿性,故Mg的金屬性強于Al的金屬性,
故答案為:在MgCl
2 溶液和AlCl
3 溶液中分別加NaOH 溶液至過量;MgCl
2溶液中產生沉淀且不消失,AlCl
3溶液中產生沉淀后完全溶解.
分析:(1)題意要求氧氣消耗掉,同時廣口瓶中壓強減小液面上升,分析炭粉、鐵粉、紅磷與氧氣的反應產物及反應條件,即可確定正確選項;
(2)通過審題、分析裝置圖,即可確定廣口瓶內水面高于廣口瓶外水面,從而采取正確方法使內外液面相平;
(3)由題意知,反應物已知,要寫化學方程式關鍵在于確定出生成物,生成物的確定可把Mg
3N
2看成先與水反應,然后產物再與鹽酸反應;
(4)掌握空氣中的成分與鎂反應的方程式,結合步驟4中要得到一種能使濕潤紅色石蕊試紙變藍的氣體,即可確定蒸發皿中的固體應為Mg
3N
2,再進一步分析氧氣和氮氣與鎂反應的活潑性;
(5)金屬性強弱依據有:①看該金屬與水反應的難易,與水反應越容易,金屬性越強,②看該金屬與酸反應的難易,與酸反應越容易,金屬性越強,③看該金屬最高價氧化物對應水化物的堿性強弱,堿性越強,該金屬金屬性越強.根據③設計不同的實驗方案.
點評:本題考查元素及其化合物,首先要熟悉物質的化學性質及化學用語,其次要認真審題,結合題目的已知條件進行分析,得出結論.

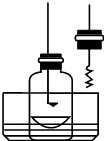 某化學興趣小組查閱資料得知鎂可在氮氣中燃燒生成Mg3N2,并設計如下實驗方案進行探究.
某化學興趣小組查閱資料得知鎂可在氮氣中燃燒生成Mg3N2,并設計如下實驗方案進行探究. CO2,由方程式可知,一方面消耗O2的體積等于生成CO2的體積,廣口瓶內液面不會上升,步驟2中就無需調節廣口瓶內外液面相平.另一方面生成的CO2可以與Mg反應,致使蒸發皿中得到的固體含有MgO.故A錯誤;
CO2,由方程式可知,一方面消耗O2的體積等于生成CO2的體積,廣口瓶內液面不會上升,步驟2中就無需調節廣口瓶內外液面相平.另一方面生成的CO2可以與Mg反應,致使蒸發皿中得到的固體含有MgO.故A錯誤; 2P2O5,除去廣口瓶中的氧氣,導致廣口瓶內壓強減小,液面上升,故C正確;
2P2O5,除去廣口瓶中的氧氣,導致廣口瓶內壓強減小,液面上升,故C正確; Mg3N2、O2+2Mg
Mg3N2、O2+2Mg 2MgO、CO2+2Mg
2MgO、CO2+2Mg 2MgO+C),但氧氣比氮氣活潑,氧氣首先與鎂反應生成MgO(與CO2反應也是生成MgO),進行步驟4中實驗時,無NH3生成,不能使濕潤紅色石蕊試紙變藍.
2MgO+C),但氧氣比氮氣活潑,氧氣首先與鎂反應生成MgO(與CO2反應也是生成MgO),進行步驟4中實驗時,無NH3生成,不能使濕潤紅色石蕊試紙變藍.



 [AgI2]-
[AgI2]-

 某化學興趣小組使用酸堿中和滴定法測定市售白醋(主要成分為CH3COOH)的總酸量(g/100ml).
某化學興趣小組使用酸堿中和滴定法測定市售白醋(主要成分為CH3COOH)的總酸量(g/100ml).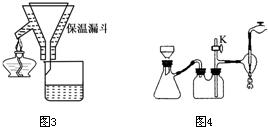 本題包括A、B兩小題,分別對應于“物質結構與性質”和“實驗化學”兩個選修模塊的內容.請選定其中一題,并在相應和答題區域內作答.若兩題都做,則按A題評分.
本題包括A、B兩小題,分別對應于“物質結構與性質”和“實驗化學”兩個選修模塊的內容.請選定其中一題,并在相應和答題區域內作答.若兩題都做,則按A題評分.