
【題目】根據反應路線及所給信息填空。
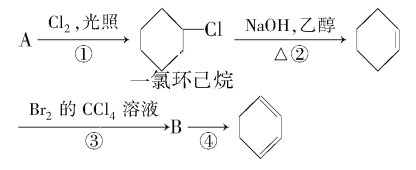
(1)A的結構簡式是________。
(2)①②的反應類型分別是_______,②的反應方程式是_________。
(3)反應③的化學方程式是________。
(4)反應④的化學方程式是________。
【答案】![]() 取代反應,消去反應
取代反應,消去反應 ![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O
+NaCl+H2O ![]() +Br2→
+Br2→![]()
![]() +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O
+2NaBr+2H2O
【解析】
由合成路線可知,反應①為光照條件下的取代反應,所以A為![]() ,反應②為鹵代烴發生的消去反應,反應③為環己烯的加成反應,則B為
,反應②為鹵代烴發生的消去反應,反應③為環己烯的加成反應,則B為![]() ,反應④為鹵代烴的消去反應,生成環己二烯,結合物質的性質及化學用語來解答。
,反應④為鹵代烴的消去反應,生成環己二烯,結合物質的性質及化學用語來解答。
(1)由上述分析可知,A為環己烷,其結構簡式為為![]() ,故答案為:
,故答案為:![]() ;
;
(2)反應①為取代反應,②為消去反應,反應②是一氯環己烷發生鹵代烴的消去反應生成環己烯,反應化學方程式為:![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O,故答案為:取代反應;消去反應;
+NaCl+H2O,故答案為:取代反應;消去反應;![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O;
+NaCl+H2O;
(3)反應③為環己烯的加成反應,反應方程式為![]() +Br2→
+Br2→![]() ,反應④是鹵代烴在氫氧化鈉醇溶液、加熱條件下發生的消去反應,反應方程式為:
,反應④是鹵代烴在氫氧化鈉醇溶液、加熱條件下發生的消去反應,反應方程式為:![]() +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O,故答案為:
+2NaBr+2H2O,故答案為:![]() +Br2→
+Br2→![]() ;
;![]() +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O。
+2NaBr+2H2O。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】
鉀和碘的相關化合物在化工、醫藥、材料等領域有著廣泛的應用。回答下列問題:
(1)元素K的焰色反應呈紫紅色,其中紫色對應的輻射波長為_______nm(填標號)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基態K原子中,核外電子占據的最高能層的符號是_________,占據該能層電子的電子云輪廓圖形狀為___________。K和Cr屬于同一周期,且核外最外層電子構型相同,但金屬K的熔點、沸點等都比金屬Cr低,原因是___________________________。
(3)X射線衍射測定等發現,I3AsF6中存在I3+離子。I3+離子的幾何構型為_____________,中心原子的雜化形式為________________。
(4)KIO3晶體是一種性能良好的非線性光學材料,具有鈣鈦礦型的立體結構,邊長為a=0.446nm,晶胞中K、I、O分別處于頂角、體心、面心位置,如圖所示。K與O間的最短距離為______nm,與K緊鄰的O個數為__________。
(5)在KIO3晶胞結構的另一種表示中,I處于各頂角位置,則K處于______位置,O處于______位置。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】t ℃時,某平衡體系中含有 X、Y、Z、W 四種物質,此溫度下發生反應的平衡常數表達式如右:![]() 。有關該平衡體系的說法正確的是 ( )
。有關該平衡體系的說法正確的是 ( )
A.當混合氣體的平均相對分子質量保持不變時,反應達平衡
B.增大壓強,各物質的濃度不變
C.升高溫度,平衡常數K增大
D.增加X的量,平衡既可能正向移動,也可能逆向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁及其化合物在生產、生活等方面有廣泛的應用。
(1)鋁元素位于周期表中第________周期________族。硼、鎵與鋁位于同一主族,現有下列三種物質:①NaAlO2、②NaBO2、③NaGaO2,濃度相同的這三種物質的溶液pH由大到小的順序為________(用序號表示)。
(2)將20.0 mL 0.1 mol·L-1 Ba(OH)2溶液和20.0 mL 0.1 mol·L-1 NH4Al(SO4)2溶液混合,所得溶液中Al3+、NH![]() 、SO
、SO![]() 、OH-、H+的濃度由大到小的順序為________________________。
、OH-、H+的濃度由大到小的順序為________________________。
(3)氮化鋁(AlN)是一種新型的無機非金屬材料,可用作熱交換器材料。某AlN樣品中僅含有Al2O3雜質,為測定AlN的含量,甲組同學設計了如下流程:

已知:AlN+NaOH+H2O=NaAlO2+NH3↑。
①過濾時用到的玻璃儀器有燒杯、漏斗和________。
②實驗過程中,稱得樣品的質量為4.2 g,最后得到的固體為5.1 g,則樣品中AlN的質量分數為________。(不考慮整個過程中的損耗)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() ,該有機物能發生( )
,該有機物能發生( )
①取代反應,②加成反應,③消去反應,④使溴水褪色,⑤使酸性KMnO4溶液褪色,⑥與AgNO3溶液生成白色沉淀,⑦聚合反應
A.以上反應均可發生B.只有⑦不能發生
C.只有⑥不能發生D.只有②不能發生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用元素的化合價推測物質的性質是化學研究的重要手段。如圖是硫元素的常見化合價與部分物質類別的對應關系:
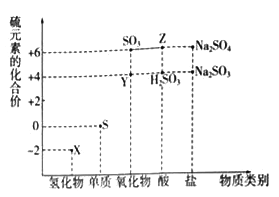
(1)從硫元素化合價變化的角度分析,圖中既有氧化性又有還原性的化合物有_______(填化學式)。
(2)將X與Y混合,可生成淡黃色固體,該反應中氧化劑與還原劑的物質的量之比為_______。
(3)Z的濃溶液與銅單質在一定條件下可以發生化學反應,該反應的化學方程式為_______。
(4)Na2S2O3是重要的化工原料.從氧化還原反應的角度分析,下列制備Na2S2O3的方案理論上可行的是______(填代號)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化為Na2SO4則24mL 0.05molL﹣1的Na2SO3溶液與 20mL 0.02molL﹣1的K2Cr2O7溶液恰好反應時,Cr元素在還原產物中的化合價為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示晶體結構是一種具有優良的電壓、電光等功能的晶體材料的最小結構單元(晶胞).晶體內與每個“Ti”緊鄰的氧原子數和這種晶體材料的化學式分別是(各元素所帶電荷均已略去)( )
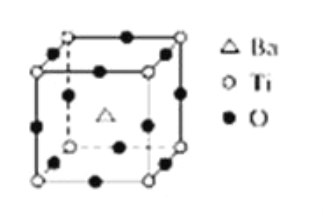
A. 8;BaTi8O12
B. 8;BaTi4O9
C. 6;BaTiO3
D. 3;BaTi2O3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中能大量共存的是
A. ![]() 的溶液中:K+、Na+、CO32-、NO3-
的溶液中:K+、Na+、CO32-、NO3-
B.澄清透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
C.c(Fe2+)=1 mol/L的溶液中: Na+、NH4+、AlO2-、SO42-
D.能使甲基橙變紅的溶液中: K+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮、硫的化合物合成、應用以及對環境的影響一直是科學界研究的熱點。
(1)尿素主要以NH3和CO2為原料進行合成。主要通過以下兩個反應進行:
反應1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反應2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
請回答:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=_____________,該反應能自發進行的主要原因是__________________.
2NH3(l)+CO2(g) ΔH3=_____________,該反應能自發進行的主要原因是__________________.
(2)焦炭催化還原SO2生成S2,化學方程式為:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2與足量的焦炭反應,SO2的轉化率隨溫度的變化如圖所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2與足量的焦炭反應,SO2的轉化率隨溫度的變化如圖所示。
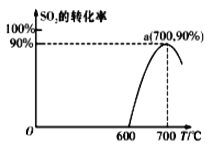
①若700℃發生該反應,經3分鐘達到平衡,計算0—3分鐘v(S2)=_______molL-1min-1,該溫度下的平衡常數為_________.
②若該反應在起始溫度為700℃的恒容絕熱容器中進行,達到平衡時SO2的轉化率________90%(填“>”、“<”或“=”).
③下列說法一定能說明該反應達到平衡狀態的是_______.
A.焦炭的質量不再變化時
B.CO2、SO2的濃度相等時
C.SO2的消耗速率與CO2的生成速率之比為1:1
D.容器的總壓強不再變化時
(3) NO2、O2和熔融KNO3可制作燃料電池,其原理如圖所示.

石墨I附近發生的反應為__________________________________,當外電路通過1mole-,正極上共消耗_______mol N2O5 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com