

分析 (1)SO2多余的尾氣一般通過NaOH溶液來吸收反應生成亞硫酸鈉和水;二氧化硫易溶于水需要防倒吸吸收;
(2)驗證上述反應所產生的各種產物,應避免二氧化硫對二氧化碳檢驗產生的干擾,裝置D是碳和濃硫酸的發生反應,生成的氣體利用A檢驗生成的水蒸氣,利用裝置E檢驗二氧化硫的存在,通過裝置C除去二氧化硫,再通過裝置E檢驗二氧化硫是否除凈,通過裝置B中澄清石灰水檢驗二氧化碳的存在;
(3)酸雨腐蝕鋼鐵是鐵和稀硫酸反應生成硫酸亞鐵和氫氣;
(4)SO2是還原劑,在反應中硫元素化合價+4價升高,標注反應中硫元素化合價變化分析判斷選項.
解答 解:(1)實驗室制備SO2多余的尾氣一般通過NaOH溶液來吸收,此反應的化學方程式為:SO2+2NaOH=Na2SO3+H2O,二氧化硫易溶于水,可用于SO2吸收的裝置需要防止倒吸,裝置AC和直接通入水中相同,容易引起倒吸,裝置B中倒扣在水面的漏斗可以防止倒吸,裝置D中的干燥管上方面積較大,可以防止倒吸,故選BD,
故答案為:SO2+2NaOH=Na2SO3+H2O;BD;
(2)驗證上述反應所產生的各種產物,應避免二氧化硫對二氧化碳檢驗產生的干擾,裝置D是碳和濃硫酸的發生反應,生成的氣體利用A檢驗生成的水蒸氣,利用裝置E檢驗二氧化硫的存在,通過裝置C除去二氧化硫,再通過裝置E檢驗二氧化硫是否除凈,通過裝置B中澄清石灰水檢驗二氧化碳的存在
①實驗中裝置A中無水硫酸銅可以觀察到的現象是白色變為藍色,裝置D中①儀器的名稱是分液漏斗,故答案為:變藍; 分液漏斗;
②增加一個E裝置,驗證SO2是否除凈,避免對CO2檢驗時的干擾,所以方案Ⅱ更合理,
故答案為:Ⅱ;增加一個E裝置,驗證SO2是否除凈,避免對CO2檢驗時的干擾;
(3)酸雨是由SO2經過一系列轉化最終生成硫酸,酸雨會嚴重腐蝕鋼鐵,酸雨腐蝕鋼鐵的過程中發生的化學反應方程式為:Fe+H2SO4=FeSO4+H2↑,
故答案為:Fe+H2SO4=FeSO4+H2↑;
(4)A.SO2+Cl2+2H2O=2HCl+H2SO4 反應中硫元素化合價升高做還原劑,故A正確;
B.SO2+2H2S=3S↓+2H2O,反應中二氧化硫中元素化合價+4價變化為0價,化合價降低做氧化劑,故B錯誤;
C.SO2+H2O=H2SO3 反應中硫元素化合價不變,不是氧化還原反應,故C錯誤;
D.5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,反應中硫元素化合價+4價變化為+6價,二氧化硫做還原劑,故D正確;
故答案為:AD.
點評 本題考查了物質性質的分析應用,主要是硫及其化合物性質、氣體實驗驗證的方法和反應現象反判斷,掌握基礎是解題關鍵,題目難度中等.


 同步練習強化拓展系列答案
同步練習強化拓展系列答案科目:高中化學 來源: 題型:選擇題
| A. | 容器內氣體密度不再發生變化 | |
| B. | 容器內各物質的濃度不再發生變化 | |
| C. | v正(H2)=v逆(NH3) | |
| D. | 單位時間消耗0.1mol N2的同時生成0.2mol NH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
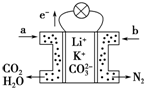 某種熔融碳酸鹽燃料電池以Li2CO3、K2CO3為電解質,以C4H10為燃料時,該電池工作原理如圖.下列說法正確的是( )
某種熔融碳酸鹽燃料電池以Li2CO3、K2CO3為電解質,以C4H10為燃料時,該電池工作原理如圖.下列說法正確的是( )| A. | a為C4H10,b為CO2 | |
| B. | 在熔融電解質中,CO32-向正極移動 | |
| C. | 此電池在常溫時也能工作 | |
| D. | 通入丁烷的一極是負極,電極反應為:C4H10-26e-+13CO32-=17CO2↑+5H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 猜想1 | 猜想2 | 猜想3 |
| 只有CO | 只有 | 含有CO和CO2 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 項 目 | 每100克(g) | 營養素參考值% |
| 能 量 | 1500kJ | 18% |
| 蛋 白 質 | 0g | 0% |
| 脂 肪 | 2.0g | 3% |
| 碳水化合物 | 72g | 24% |
| 鈉 | 30mg | 2% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ③④⑤ | C. | ⑤⑥⑦ | D. | ②③⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AgI比AgCl穩定 | B. | 碘氧化性比氯弱 | ||
| C. | I-的還原性比Cl-強 | D. | 溶解度AgI<AgCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯和聚乙烯均能使溴水褪色 | |
| B. | 甲烷、苯和油脂均不能使酸性KMnO4溶液褪色 | |
| C. | 乙酸和乙酸乙酯均能發生取代反應 | |
| D. | 蔗糖和麥芽糖是同分異構體,均可以水解且產物相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com