
【題目】設NA為阿伏加德羅常數,則下列敘述中正確的是
A. 6.02×1022個H2SO分子在水中可電離生成2NA個H+
B. 在0℃、101kPa時,22.4L氫氣中含有NA個氫原子
C. 14g氮氣中含有7NA個電子
D. NA個一氧化碳分子和0.5mol甲烷的質量比為7︰4
【答案】C
【解析】
A.6.02![]() 個H2SO4的物質的量為:n=
個H2SO4的物質的量為:n=![]() =0.1mol,0.1mol硫酸在水中能電離生成0.2mol氫離子,即0.2NA個氫離子,故A錯誤;
=0.1mol,0.1mol硫酸在水中能電離生成0.2mol氫離子,即0.2NA個氫離子,故A錯誤;
B.0℃、101kPa即標況,氣體摩爾體積為22.4L/mol,則22.4L氫氣的物質的量,n=![]() =1mol,1mol氫氣含2mol氫原子,,即2NA個,故B錯誤;
=1mol,1mol氫氣含2mol氫原子,,即2NA個,故B錯誤;
C.14g氮氣的物質的量為:n=![]() =0.5mol,而1mol氮氣含14mol電子,故0.5mol氮氣含7mol電子,即7NA個電子,故C正確;
=0.5mol,而1mol氮氣含14mol電子,故0.5mol氮氣含7mol電子,即7NA個電子,故C正確;
D.NA個CO的物質的量是1mol,1molCO質量為:m=1mol![]() =28g,0.5mol甲烷的質量m=0.5mol
=28g,0.5mol甲烷的質量m=0.5mol![]() =8g,故質量比為28g:8g=7:2,故D錯誤;
=8g,故質量比為28g:8g=7:2,故D錯誤;
本題答案為C。


科目:高中化學 來源: 題型:
【題目】下列有關硅及其化合物的敘述中,錯誤的是
A.單質硅是良好的半導體材料
B.硅和碳是都是第ⅣA族的元素
C.二氧化硅用來制造通訊材料(光導纖維)
D.二氧化硅溶于水生成硅酸,它是揮發性酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為元素在生物體內的含量分布情況,下列表述不正確的是( )
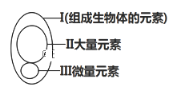
A. Ⅰ在非生物界中都能找到,體現了生物界與非生物界的統一性
B. Ⅲ含量雖少,卻是生物體正常生命活動不可缺少的
C. Ⅱ和Ⅲ為生物體的必需元素,一旦缺乏就可能會導致相應的病癥
D. P、S、K、Ca、Zn屬于大量元素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將等物質的量濃度的CuSO4和NaCl等體積混合后,用石墨電極進行電解,電解過程中,溶液pH隨時間t變化的曲線如圖,則下列說法正確的是( )

A. 陽極產物一定是Cl2,陰極產物一定是Cu
B. 整個過程中陽極先產生Cl2,后產生O2
C. BC段表示在陰極上是H+放電產生了H2
D. CD段表示陽極上OH-放電破壞了水的電離平衡,產生了H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaBH4容易與H+反應產生氫氣而成為儲氫材料研究的熱點。以硼酸為原料制備NaBH4的一種工藝流程如下圖所示:
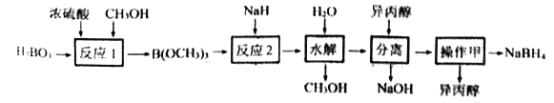
已知: ①H3BO3電離:H3BO3+H2O![]() [B(OH)4]-+H+
[B(OH)4]-+H+
②反應1: H3BO3+3CH3OH![]() B(OCH3)3+3H2O
B(OCH3)3+3H2O
③反應2:B(OCH3)3+4NaH= NaBH4+ 3CH3ONa
(1)H3BO3是____元酸,NaH的電子式為_______________。
(2)NaBH4與水劇烈反應放出H2。反應的化學方程式為________________。
(3)反應1屬于______(填有機反應類型),反應過程中蒸出B(OCH3)3的目的是__________。
(4)“水解”時產生的大量NaOH,減緩了NaBH4與水的反應。在該步驟中,與水反應生成大量NaOH的物質是_________。
(5)“分離”后得到NaBH4的異丙醇溶液。操作甲是_____________。
(6)上述流程中可以循環使用的物質是____________。
(7)以惰性電極電解Na[B(OH)4]與NaOH 混合溶液也能制得NaBH4。陰極的電極反應式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在恒容密閉容器中,能表示反應X(g)+2Y(g) ![]() 2Z(g)一定達到化學平衡狀態的是( )
2Z(g)一定達到化學平衡狀態的是( )
①X、Y、Z的物質的量之比為1∶2∶2
②X、Y、Z的濃度不再發生變化
③容器中的壓強不再發生變化
④單位時間內生成n mol Z,同時生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工廠的尾氣主要成分為N2、NO、CO、CO2、SO2等,某興趣小組設計以下實驗,定量檢測尾氣中污染性氣體的含量。
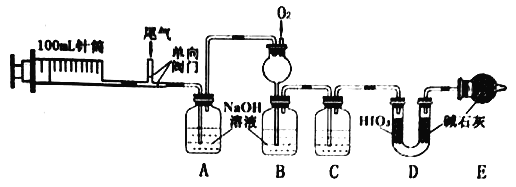
(1)實驗時,先推送N2,再連續抽送20次(100mL/次)尾氣,最后推送N2。
①第一次推送N2的作用是________。
②尾氣采用多次抽送方式的目的是________。
(2)C中的試劑是____________。
(3)裝置D用于測量CO。
①HIO3能氧化CO,還原產物為I2,反應的化學方程式為____________。
②D中堿石灰的作用是_________。
(4)為進一步分析SO2含量,將實驗后A中溶液轉移到燒杯,依次加入三種試劑,過濾、洗滌、干燥。稱得沉淀為1.165g。
①加入的三種試劑為_______。(選填序號)
a.鹽酸 b.雙氧水 c.BaCl2溶液 d.稀硫酸
②檢驗沉淀是否洗滌干凈的方法是_____________。
③尾氣中SO2含量為_____gL-1。
(5)實驗后,測得B中溶液體積為100mL,NO2-、NO3- 的濃度分別為0.0100molL-1和0.0200molL-1。
①B中長頸漏斗的作用是_____________;
②通入O2的體積(標準狀況)至少為___________mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是( )

圖Ⅰ 圖Ⅱ 圖Ⅲ 圖Ⅳ
A. 圖Ⅰ表示H2與O2發生反應過程中的能量變化,則H2的燃燒熱△H=-241.8 kJ·mol-1
B. 圖Ⅱ表示反應A2 (g)+ 3B2 (g)![]() 2AB3(g),達到平衡時A2的轉化率大小為:b>a>c
2AB3(g),達到平衡時A2的轉化率大小為:b>a>c
C. 圖Ⅲ表示0.1mol MgCl2·6H2O在空氣中充分加熱時固體質量隨時間的變化
D. 圖Ⅳ表示常溫下,稀釋HA、HB兩種酸的稀溶液時,溶液pH隨加水量的變化,則NaA溶液的pH大于同濃度NaB溶液的pH
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com