
某礦石可能是由FeCO3、SiO2、Al2O3中的一種或幾種組成,某研究性學習小組欲分析其成分,實驗記錄如下圖所示。
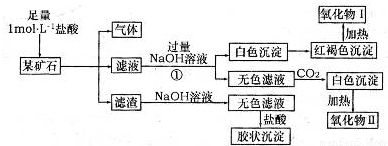
(1)該礦石中含有 (填化學式),請寫出實驗過程①中反應的離子方程式 。
(2)將氧化物Ⅱ在熔融狀態(tài)下電解,可以得到某金屬單質。當陽極上收集到氣體33.6L(已折算成標準狀況)時,陰極上得到該金屬 g。
(3)試寫出該金屬與氧化物I反應的化學方程式 ;將該反應的產物加入到足量燒堿溶液中,請寫出發(fā)生反應的離子方程式 。
(4)經進一步分析該礦石中還含有微量的SrCO3(上述方案檢測不出)。鍶(Sr)為第五周期ⅡA族元素。下列敘述正確的是 (填序號)。
①氯化鍶(SrCl2)溶液顯酸性
②SrSO4難溶于水
③工業(yè)上可以用電解SrCl2的水溶液制取金屬鍶(Sr)
④高純六水氯化鍶晶體(SrCl2·6H2O)必須在HCl氛圍中加熱才能得到SrCl2
(1)FeCO3、SiO2、Al2O3(3分,少一種或多一種扣1分);
H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓、Al3++4OH-=AlO2-+2H2O;(3分,每個1分)
(2)54(2分);
(3)2Al+Fe2O3 Al2O3+2Fe(2分);Al2O3+2OH-+2H2O=2[Al(OH)4]-或Al2O3+2OH-=2AlO2-+H2O(2分);
Al2O3+2Fe(2分);Al2O3+2OH-+2H2O=2[Al(OH)4]-或Al2O3+2OH-=2AlO2-+H2O(2分);
(4)②(2分)
【解析】
試題分析:礦石可能是由FeCO3、SiO2、Al2O3中的一種或幾種組成,加鹽酸生成氣體為二氧化碳,則一定含FeCO3;加鹽酸后的濾渣為SiO2,膠狀沉淀為硅酸;結合轉化關系可知,濾液中含氯化亞鐵、氯化鋁、鹽酸,反應①中加足量堿,生成白色沉淀為Fe(OH)2,紅褐色沉淀為Fe(OH)3,則氧化物I為Fe2O3;無色濾液中含NaAlO2,通二氧化碳生成的白色沉淀為Al(OH)3,則氧化物II為Al2O3,然后結合單質、化合物的性質及化學用語來解答。
(1)由上述分析可知,礦石中含FeCO3、SiO2、Al2O3,①中反應的離子方程式為H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓、Al3++4OH-=AlO2-+2H2O;
(2)由4Al~3O2↑可知,陽極上收集到氣體33.6L(已折算成標準狀況)時,陰極上得到該金屬為
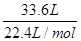 ×
×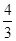 ×27g/mol=54g,故答案為:54;
×27g/mol=54g,故答案為:54;
(3)金屬與氧化物I反應的化學方程式為2Al+Fe2O3 Al2O3+2Fe,該反應的產物加入到足量燒堿溶液中,氧化鋁與堿反應的離子方程式為Al2O3+2OH-+2H2O=2[Al(OH)4]-或Al2O3+2OH-=2AlO2-+H2O
Al2O3+2Fe,該反應的產物加入到足量燒堿溶液中,氧化鋁與堿反應的離子方程式為Al2O3+2OH-+2H2O=2[Al(OH)4]-或Al2O3+2OH-=2AlO2-+H2O
(4)鍶(Sr)為第五周期ⅡA族元素,由同主族元素性質的相似性可知,
①氯化鍶(SrCl2)溶液,為強堿強酸鹽溶液,顯中性,故錯誤;
②由硫酸鋇難溶于水,則SrSO4難溶于水,故正確;
③工業(yè)上可以用電解SrCl2的水溶液,金屬陽離子不能得到電子,所以不能制取金屬鍶(Sr),故錯誤;
④高純六水氯化鍶晶體(SrCl2•6H2O)加熱才能得到SrCl2,不存在水解,故錯誤;
故答案為:②。
考點:考查探究物質的組成或測量物質的含量;物質分離和提純的方法和基本操作綜合應用;物質的檢驗和鑒別的基本方法選擇及應用.。


科目:高中化學 來源: 題型:
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源:2012-2013學年四川成都棠湖中學外語實驗學校高二5月月考化學卷(帶解析) 題型:填空題
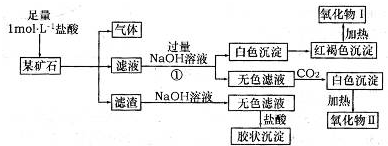
欲探究某礦石可能是由FeCO3、SiO2、Al2O3中的一種或幾種組成,探究過程如下圖所示。(已知:碳酸不能溶解Al(OH)3沉淀)
(1)用濾渣制備粗硅的化學反應方程式為
(2)下列說法正確的是
a.酸性:H2CO3>H2SiO3 b.結合質子的能力:CO> AlO2->HCO3-
c.穩(wěn)定性:H2O>CH4>SiH4 d.離子半徑:O2-<Al3+
(3)濾渣和NaOH溶液反應的離子方程式是
通過 現象說明此礦山中不含Al2O3
(4)該礦石和稀HNO3發(fā)生氧化還原反應的離子方程式為
(5)工業(yè)上依據上述實驗原理處理該礦石,將反應池逸出的氣體與一定量的O2混合循環(huán)通入反應池中,主要兩個目的是 , ;
若處理該礦石2.36×103 kg,得到濾渣1.2×103 kg ,理論上至少需要1 mol L-1 HNO3的體積為 L。
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com