
科目:高中化學 來源:不詳 題型:填空題

| 時間(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2NH3。已知平衡時NH3的濃度是c mol·L-1,現(xiàn)按下列四種配比作為起始物質(zhì),分別充入上述容器,并保持溫度不變,則達到平衡后,NH3的濃度不為c mol·L-1的是
2NH3。已知平衡時NH3的濃度是c mol·L-1,現(xiàn)按下列四種配比作為起始物質(zhì),分別充入上述容器,并保持溫度不變,則達到平衡后,NH3的濃度不為c mol·L-1的是| A.1.0體積的N2和3.0體積的H2 |
| B.2.0體積的N2、6.0體積的H2和4.0體積的NH3 |
| C.2.0體積的NH3 |
| D.4.0體積的NH3和1.0體積的H2 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2SO3(g);△H=-akJ·mo1-2在相同條件下要想得到2akJ熱量,加入各物質(zhì)的物質(zhì)的量可能是( )
2SO3(g);△H=-akJ·mo1-2在相同條件下要想得到2akJ熱量,加入各物質(zhì)的物質(zhì)的量可能是( )| A.4 mo1SO2和2mol O2 | B.4mol SO2、2mo1 O2和2mol SO3 |
| C.4mol SO2.和4 mo1 O2 | D.6mo1 SO2和4 mo1 O2 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

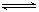 XeF4(g)+F2(g),
XeF4(g)+F2(g),查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.改變條件,反應物的轉(zhuǎn)化率增大,平衡常數(shù)也一定增大 |
B.反應2NO2(g)  N2O4(g) △H<0,升高溫度該反應平衡常數(shù)增大 N2O4(g) △H<0,升高溫度該反應平衡常數(shù)增大 |
| C.對于給定可逆反應,溫度一定時,其正、逆反應的平衡常數(shù)相等 |
D.平衡常數(shù)為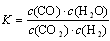 的反應,化學方程式為CO2+H2 的反應,化學方程式為CO2+H2 CO+H2O CO+H2O |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
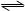 2C+3D的化學反應速率與化學平衡隨外界條件改變(先降溫后加壓)而變化的情況,由此可以推斷
2C+3D的化學反應速率與化學平衡隨外界條件改變(先降溫后加壓)而變化的情況,由此可以推斷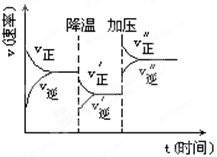
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.可逆反應的特征是反應物和生成物的濃度相等 |
| B.在其他條件不變時,升高溫度可以使化學平衡向放熱反應的方向移動 |
| C.在其他條件不變時,使用催化劑可以改變化學反應速率,但不能改變化學平衡狀態(tài) |
| D.在其他條件不變時,增大壓強一定會破壞有氣體存在的反應的平衡狀態(tài) |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com