
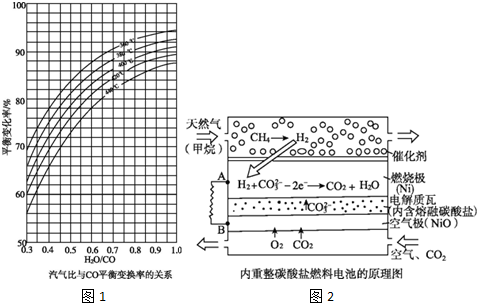
分析 Ⅰ.(1)依據熱化學方程式和蓋斯定律計算得到所需熱化學方程式;
(2)依據圖象中曲線的變化分析存在的變化規律,采取定一議二的方法分析歸納;
(3)將化學平衡常數中的濃度c換成壓強P就可以得到KP;反應是放熱反應,升高溫度平衡逆向進行;
Ⅱ.該燃料電池中,通入甲烷的一極為原電池的負極,發生氧化反應,電極反應式為CH4-8e-+4CO32-=5CO2+2H2O,通入空氣和CO2的混合氣體一極為原電池的正極,發生還原反應,電極反應式為O2+4e-+2CO2=2CO32-;
(1)原電池原理分析,電子流向是從負極流向正極,裝置中A為負極,B為正極,所以外電路電子流向為A流向B;
(2)空氣極是氧氣得到電子,生成碳酸根離子的反應;
(3)依據電子守恒結合電極反應計算得到;
解答 解:Ⅰ.(1)①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
②CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ/mol
依據蓋斯定律計算②-①得到:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol;
故答案為:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol;
(2)①依據圖象曲線變化分析可知,溫度一定,汽氣比越大CO平衡變化率越大;
故答案為:汽氣比越大CO平衡變化率越大;
②汽氣比相同時,圖象分析可知,CO平衡變換率與溫度的關系是,溫度越高,CO平衡變化率越小;
故答案為:溫度越高CO平衡變化率越小;
(3)CH4(g)+H2O(g)?CO(g)+3H2(g),對于氣相反應,用某組分(B)的平衡壓強(pB)代替物質的量濃度也可以表示平衡常數(記作Kp),反應的平衡常數=$\frac{P(C{O}_{2})•P({H}_{2})}{P(CO)•P({H}_{2}O)}$;反應是放熱反應,升高溫度平衡向吸熱反應方向移動,平衡逆向進行,平衡常數增大;
故答案為:$\frac{P(C{O}_{2})•P({H}_{2})}{P(CO)•P({H}_{2}O)}$; 增大;
Ⅱ.(1)原電池原理分析,電子流向是從負極流向正極,裝置中A為負極,B為正極,所以外電路電子流向為A流向B;
故答案為:A;B;
(2)原電池正極上的電極反應式為O2+4e-+2CO2=2CO32-,
故答案為:O2+4e-+2CO2=2CO32-;
(3)電解精煉銅,陰極上銅離子得到電子生成銅,電極反應Cu2++2e-=Cu,當電路有0.6mol e-轉移反應生成銅0.3mol,質量=0.3mol×64g/mol=19.2 g;
故答案為:19.2.
點評 本題考查了熱化學方程式書寫,圖象分析判斷的方法應用,原電池原理的分析判斷和電極反應的分析判斷,題目難度中等,掌握基礎是解題的關鍵,試題培養了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:選擇題
| 研究目的 | 溫度(T) 對反應的影響 | 壓強(p)對平衡常數的影響 | 壓強(p)對反應的影響(p2>p1) | 溫度(T)對反應的影響(T1>T2) |
| 圖示 | 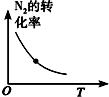 | 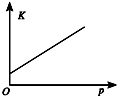 | 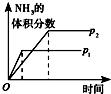 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
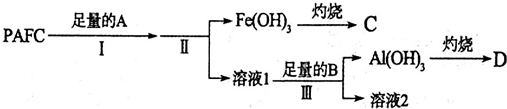
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
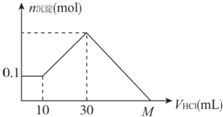 某一固體物質可能由NaOH、AlCl3、MgCl2中的幾種組成,將其一定量溶于水,有沉淀產生,在所得懸濁液中逐滴加入5 mol/L的鹽酸,圖表示鹽酸加入量與沉淀量的變化關系,圖中M點表示已加入的鹽酸體積,則M點的體積是( )
某一固體物質可能由NaOH、AlCl3、MgCl2中的幾種組成,將其一定量溶于水,有沉淀產生,在所得懸濁液中逐滴加入5 mol/L的鹽酸,圖表示鹽酸加入量與沉淀量的變化關系,圖中M點表示已加入的鹽酸體積,則M點的體積是( )| A. | 70 mL | B. | 90 mL | C. | 100 mL | D. | 130 mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
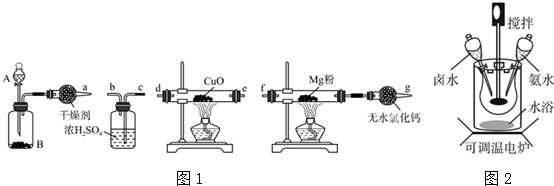
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
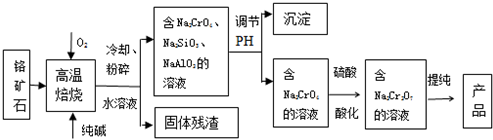
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含等物質的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| B. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| C. | 加水稀釋CH3COONa溶液,溶液中$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$的值變小 | |
| D. | 25℃時,pH=4的鹽酸與pH=4的醋酸溶液等體積混合后pH=4 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | pH=2的HA溶液與pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | B氨水和鹽酸混合后溶液呈酸性,溶液中可能存在:c(NH4+)>c(Cl-) | |
| C. | 在一定溫度下,相同pH的硫酸和硫酸鐵溶液中水電離出來的c(H+)分別是1.0×0×10-amol/L和是1.0×10-bmol/L,在此溫度時,水的離子積為1.0×10-(a+b) | |
| D. | 常溫下,0.1mol/L酸HA pH=3,0.1mol/L 堿BOH pH=13,則鹽BA溶液的pH<7 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com