
【題目】恒溫恒容下,將2 mol A氣體和2 mol B氣體通入體積為2 L的密閉容器中發生如下反應:2A(g)+B(g)![]() xC(g)+2D(s),2 min時反應達到平衡狀態,此時剩余1.2 mol B,并測得C的濃度為1.2 mol·L-1。
xC(g)+2D(s),2 min時反應達到平衡狀態,此時剩余1.2 mol B,并測得C的濃度為1.2 mol·L-1。
(1)x=________。
(2)從開始反應至達到平衡狀態,生成C的平均反應速率為________。
(3)A的轉化率與B的轉化率之比為________。
(4)平衡后A的體積分數為:___________ 。
(5)反應前與平衡后的壓強之比為________ 。
【答案】 3 0.6mol/L.min-1 2:1 10% 1:1
【解析】(1)恒溫恒容下,將2 mol A氣體和2 mol B氣體通入體積為2 L的密閉容器中發生如下反應:2A(g)+B(g)![]() xC(g)+2D(s),2 min時反應達到平衡狀態,此時剩余1.2 mol B,則消耗B是2mol-1.2mol=0.8mol,并測得C的濃度為1.2 mol·L-1,即生成C是2.4mol,根據變化量之比是相應的化學計量數之比可知x=3。(2)從開始反應至達到平衡狀態,生成C的平均反應速率為1.2mol/L÷2min=0.6mol/L·min-1。(3)消耗A是1.6mol,所以A的轉化率與B的轉化率之比為
xC(g)+2D(s),2 min時反應達到平衡狀態,此時剩余1.2 mol B,則消耗B是2mol-1.2mol=0.8mol,并測得C的濃度為1.2 mol·L-1,即生成C是2.4mol,根據變化量之比是相應的化學計量數之比可知x=3。(2)從開始反應至達到平衡狀態,生成C的平均反應速率為1.2mol/L÷2min=0.6mol/L·min-1。(3)消耗A是1.6mol,所以A的轉化率與B的轉化率之比為![]() =2:1。(4)平衡后A的體積分數為
=2:1。(4)平衡后A的體積分數為![]() ×100%=10%:(5)壓強之比是物質的量之比,根據方程式可知反應前后體積不變,則反應前與平衡后的壓強之比為1:1。
×100%=10%:(5)壓強之比是物質的量之比,根據方程式可知反應前后體積不變,則反應前與平衡后的壓強之比為1:1。


科目:高中化學 來源: 題型:
【題目】氮元素可以形成多種化合物。回答下列問題:
(1)基態氮原子的價電子排布式是____;C、N、O 三種元素電負性從小到大的順序是________。
(2)肼(N2H4)分子中氮原子軌道的雜化類型是______;肼可用作火箭燃料,燃燒時發生的反應時N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=11038.7kJ·mol-1,若該反應中8molN-H鍵斷裂,則形成的σ鍵有____mol;肼能與硫酸反應生成N2H6SO4晶體類型與硫酸銨相同,則N2H6SO4晶體內不存在______(填字母)。
A.離子鍵 B.共價鍵 C.配位鍵 D.范德華力
(3)氨是________(填“極性”或“非極性”)分子;氨的沸點高于膦(PH3)的原因是________。
(4)將氨氣通入硫酸銅水溶液中形成[Cu(NH3)4]SO4深藍色溶液,[Cu(NH3)4]SO4中陰離子的立體構型是______。
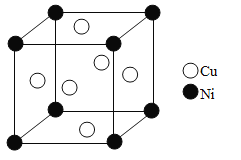
(5)單質銅和鎳都是由金屬鍵形成的晶體,元素銅和鎳的第二電離能分別為:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi的原因是_______。某鎳白銅合金的立方晶胞結構如圖所示。晶胞中鎳原子與銅原子的個數比為_______。若合金的密度為dg/cm3,晶胞參數a=_________nm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各項說法正確的是( )
A. “84”消毒液的有效成分是NaClO
B. SO2具有漂白性,可用于加工食品,使食品增白
C. 可以用酒精萃取碘水中碘單質
D. SO2氣體通入Ba(NO3)2溶液中不能產生白色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知將KI、鹽酸、試劑X和淀粉四種溶液混合,無反應發生。若再加入雙氧水,將發生反應H2O2+2H++2I-═2H2O+I2,且生成I2立即與試劑X反應而被消耗.一段時間后,試劑X將被反應生成I2完全消耗.由于溶液中I-繼續被H2O2氧化,生成I2與淀粉作用,溶液立即變藍.因此,根據試劑X量、滴入雙氧水至溶液變藍所需時間,即可推算反應H2O2+2H++2I-═2H2O+I2反應速率。下表為某同學依據上述原理設計的實驗及實驗記錄(各實驗均在室溫條件下進行):
編號 | 往燒杯中加入的試劑及其用量(mL) | 催化劑 | 溶液開始變藍時間(min) | ||||
0.1mol·L-1 KI溶液 | H2O | 0.01mol·L-1 X溶液 | 0.1mol·L-1 雙氧水 | 0.1mol·L-1 稀鹽酸 | |||
1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 無 | 1.4 |
2 | 20.0 | m | 10.0 | 10.0 | n | 無 | 2.8 |
3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 無 | 2.8 |
4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 無 | t |
5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
回答下列問題:
(1)已知:實驗1、2的目的是探究H2O2濃度對H2O2+2H++2I-═2H2O+I2反應速率的影響。
實驗2中m= ,n= 。
(2)一定溫度下,H2O2+2H++2I-═2H2O+I2,反應速率可以表示為v=k·c a(H2O2)·c b (I-)·c(H+)(k為反應速率常數),則:
①實驗4時,燒杯中溶液開始變藍的時間t=__________min;
②根據上表數據可知,a、b的值依次為 和 。
(3)若要探究溫度對H2O2+2H++2I-=2H2O+I2反應速率影響,在實驗中溫度不宜過高且采用水浴加熱,其原因是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生產生活、環境保護等密切相關。下列做法不正確的是
A. 推廣使用電動汽車低碳交通工具
B. 用CO2合成可降解的聚碳酸酯塑料
C. 用生物方法脫除生活污水中的氮和磷
D. 加大鉛酸蓄電池、含汞鋅錳等電池的生產
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列熱化學方程式:
Zn(s)+1/2O2(g)= ZnO(s) ΔH1 =a kJ/mol;
Hg(l)+1/2O2(g)= HgO(s) ΔH2 =b kJ/mol。
則反應:Zn(s)+HgO(s)= ZnO(s)+Hg(l) △H3 中,△H3的值為
A.(b-a) B.(a-b) C.(a-b)/2 D. (b-a)/2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)處理含CO、SO2煙道氣污染的一種方法是將其在催化劑作用下轉化為單質S。已知:①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反應的熱化學方程式是________________________________。
(2)氮氧化物是造成光化學煙霧和臭氧層損耗的主要氣體。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用標準狀況下3.36 L CO還原NO2至N2(CO完全反應)的整個過程中轉移電子的物質的量為____________mol,放出的熱量為____________kJ(用含有a和b的代數式表示)。
(3)用CH4催化還原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1=-574 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4還原NO2至N2,整個過程中放出的熱量為867 kJ,則ΔH2=____________。
(4)某氮肥廠氨氮廢水中的氮元素多以NH![]() 和NH3·H2O形式存在,該廢水的處理流程中,NH
和NH3·H2O形式存在,該廢水的處理流程中,NH![]() 在微生物作用的條件下經過兩步反應被氧化成NO
在微生物作用的條件下經過兩步反應被氧化成NO![]() 。兩步反應的能量變化示意如圖所示:
。兩步反應的能量變化示意如圖所示:
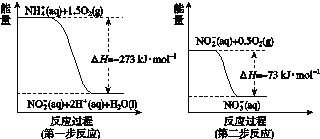
1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的熱化學方程式是________________。
(aq)的熱化學方程式是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.π鍵是由兩個p軌道“頭碰頭”重疊形成的
B.σ鍵就是單鍵,π鍵就是雙鍵
C.乙烷分子中的鍵全為σ鍵,而乙烯分子中含σ鍵和π鍵
D.H2分子中含σ鍵,而Cl2分子中含π鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式碳酸銅[xCuCO3·yCu(OH)2],呈孔雀綠顏色.又稱為孔雀石,是一種名貴的礦物寶石。它與銅與空氣中的氧氣、二氧化碳和水蒸氣等物質反應產生的物質。CuSO4溶液與Na2CO3溶液反應可以得到堿式碳酸銅,我們將對其組成進行相關探究。
[沉淀制備]
稱取12. 5 g膽礬(CuSO4 5H2O)溶于87. 5mL蒸餾水中,滴加少量稀硫酸(體積可以忽略不計),充分攪拌后得到CuSO4溶液。向其中加入Na2CO3溶液,將所得藍綠色懸濁液過濾,并用蒸餾水洗滌,再用無水乙醇洗滌,最后低溫烘干備用。
[實驗探究]我們設計了如下裝置,用制得的藍綠色固體進行實驗。

根據以上實驗回答下列問題
(1)配制硫酸銅溶液的過程中滴加稀硫酸的作用是___________,所得硫酸銅溶液的溶質質量分數為_________
(2)實驗室通常使用加熱亞硝酸鈉和氯化銨混合溶液的方法制取N2,該反應的化學方程為:__________。
⑶D裝置加熱前,需要首先打開活塞K,通入適量N2,然后關閉K,再點燃D處酒精燈。通入N2的作
用___________, B為安全瓶,其作用原理為_________,C中盛裝的試劑應是__________。
(4)加熱D后觀察到的現象是________________。
(5)經查閱文獻知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,經討論認為需要用Ba(OH)2溶液代替澄清石灰水來定量測定藍綠色固體的化學式,其原因是______________
a.Ba(OH)2的堿性比Ca(OH)2強
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同條件下,CaCO3的溶解度明顯大于BaCO3
d.吸收等量CO2生成的BaCO3的質量大于CaCO3,測量誤差小
(6)待D中反應完全后,打開活塞K,再次滴加NaNO2溶液產生N2,其目的是______________。若裝置F中使用Ba(OH)2溶液,實驗結束后經稱量,裝置E的質量增加0.27g,F中產生沉淀1.97g。則該藍綠色固體的化學式為_____________。[寫成xCuCO3·yCu(OH)2的形式]
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com