
【題目】回答下列問題:
1L海水在逐漸濃縮過程中析出鹽的種類和質量(單位:g)的關系如下表所示:
海水密度(gmL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
1.21 | 0.05 | 3.26 | 0.004 | 0.008 | — |
1.22 | 0.015 | 9.65 | 0.01 | 0.012 | — |
1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
1.31 | — | 1.40 | 0.54 | 0.03 | 0.06 |
注:畫“—”的數據少于10-4,可以忽略不計。
(1)從海水中獲得粗鹽,一般采用的方法是___。
(2)根據上表,要獲得雜質較少的食鹽,應控制海水的最佳密度為___gmL-1(填字母)。
A.1.21 B.1.22 C.1.26 D.1.31
(3)粗鹽中常含有MgCl2、MgSO4、CaCl2等雜質,要除去這些雜質,按順序加入的試劑依次為NaOH、BaCl2、___、___等(填化學式)。
(4)工業上電解熔融氯化鈉制取金屬鈉的化學方程式為___。
(5)鈉元素的一種常見氧化物可作為呼吸面具的供氧劑,寫出該氧化物和CO2反應的化學方程式___。
【答案】蒸發或日曬 B Na2CO3 HCl 2NaCl(熔融)![]() 2Na+Cl2↑ 2Na2O2+2CO2=2Na2CO3+O2
2Na+Cl2↑ 2Na2O2+2CO2=2Na2CO3+O2
【解析】
(1)在海水逐漸濃縮過程中,海水中的某些鹽的濃度會發生一定的改變,表中數值為析出鹽的質量,所以要獲取某種鹽,應選擇其析出量多的點。
(2)除去粗鹽中的雜質,某些試劑的加入存在一定的順序,也就是先加入的試劑,過量部分需要后加入試劑去除。對粗鹽提純來說,與此相關的試劑為Na2CO3和HCl,所以Na2CO3必須在加入BaCl2之后加入,HCl必須在過濾之后加入。
(1)從海水中獲得粗鹽,常需增大濃度,讓鹽水變得飽和,所以一般采用的方法是蒸發或日曬。答案為:蒸發或日曬;
(2)根據表中信息,要獲得雜質較少的食鹽,應控制海水的最佳密度為1.22gmL-1,這時析出食鹽最多,雜質最少,因此選B。答案為:B;
(3)粗鹽中常含有MgCl2、MgSO4、CaCl2等雜質,加NaOH用來除去Mg2+,加入BaCl2除去SO42-,應加入Na2CO3除去過量的Ba2+和原有的Ca2+,最后加入鹽酸除去過量的CO32-,要除去這些雜質,按順序加入的試劑依次為NaOH、BaCl2、Na2CO3、HCl。答案為:Na2CO3;HCl;
(4)工業上電解熔融氯化鈉制取金屬鈉,化學方程式為2NaCl(熔融)![]() 2Na+Cl2↑。答案為:2NaCl(熔融)
2Na+Cl2↑。答案為:2NaCl(熔融)![]() 2Na+Cl2↑;
2Na+Cl2↑;
(5)過氧化鈉可作為呼吸面具的供氧劑,它和CO2反應的化學方程式2Na2O2 + 2CO2 == 2Na2CO3 + O2。答案為:2Na2O2 + 2CO2 == 2Na2CO3 + O2。


 黃岡創優卷系列答案
黃岡創優卷系列答案科目:高中化學 來源: 題型:
【題目】若氣態烴D的密度為1.25 g/L(標準狀況),各種物質間轉化關系如下:
A![]() B
B![]() C;A
C;A![]() D
D![]() E。
E。
(1)寫出A~E的結構簡式:
A_______,B_________,C_________,D_______,E________。
(2)寫出下列反應的化學方程式:
A→B:__________________;
B→C:__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列數據:
物質 | 熔點/℃ | 沸點/℃ | 密度/ |
乙醇 |
| 78.3 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 |
| 77 | 0.90 |
某學生在實驗室制取乙酸乙酯的主要步驟如下:
①配制![]() 濃硫酸、
濃硫酸、![]() 乙醇(含
乙醇(含![]() )和
)和![]() 乙酸的混合溶液。
乙酸的混合溶液。
②按如圖連接好裝置(裝置氣密性良好)并加入混合液,用小火均勻加熱![]() 。
。
③待試管乙收集到一定量產物后停止加熱,撤出試管乙并用力振蕩,然后靜置待分層。
④分離出乙酸乙酯,洗滌、干燥。
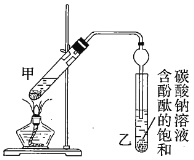
(1)配制①中混合溶液的方法為_______________________________;反應中濃硫酸的作用是____________________________;寫出制取乙酸乙酯的反應的化學方程式:____________________________(標出![]() )。
)。
(2)上述實驗中飽和碳酸鈉溶液的作用是________(填字母)。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.減少乙酸乙酯的溶解 D.加速酯的生成,提高其產率
(3)步驟②中需要小火均勻加熱,其主要原因是____________________________;步驟③所觀察到的現象是_______________________________________;欲將乙試管中的物質分離以得到乙酸乙酯,必須使用的儀器有___________;分離時,乙酸乙酯應從儀器_____________(填“下口放”或“上口倒”)出。
(4)該同學反復實驗,得出乙醇與乙酸的用量和得到的乙酸乙酯生成量如下表:
實驗 | 乙醇/ | 乙酸/ | 乙酸乙酯/ |
① | 2 | 2 | 1.33 |
② | 3 | 2 | 1.57 |
③ | 4 | 2 | x |
④ | 5 | 2 | 1.76 |
⑤ | 2 | 3 | 1.55 |
表中數據x的范圍是__________________;實驗①②⑤探究的是_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于苯乙烯(![]() )的下列敘述①能使酸性KMnO4溶液褪色、②可發生加聚反應、③可溶于水、④可溶于苯中、⑤能與濃硝酸發生取代反應、⑥所有的原子可能共平面,其中正確的是( )
)的下列敘述①能使酸性KMnO4溶液褪色、②可發生加聚反應、③可溶于水、④可溶于苯中、⑤能與濃硝酸發生取代反應、⑥所有的原子可能共平面,其中正確的是( )
A.僅①②④⑤B.僅①②⑤⑥C.僅①②④⑤⑥D.全部正確
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】華法林(Warfarin)又名殺鼠靈,為心血管疾病的臨床藥物。其合成路線(部分反應條件略去)如下所示:
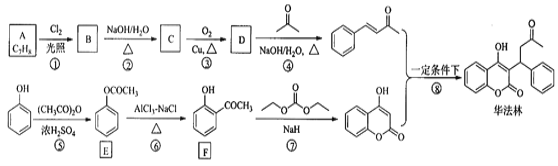
回答下列問題:
(1)A的名稱為________,E中官能團名稱為________。
(2)B的結構簡式為________。
(3)由C生成D的化學方程式為___________
(4)⑤的反應類型為_________,⑧的反應類型為________。
(5)F的同分異構體中,同時符合下列條件的同分異構體共有___________種。
a.能與FeCl3溶液發生顯色反應 b.含有-CHO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在三個體積均為2.0 L的恒容密閉容器中發生反應:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
編號 | 溫度 /℃ | 起始物質 的量/mol | 平衡物質 的量/mol | 達到平衡 所需時間/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列說法正確的是
A.平衡常數K:容器Ⅱ>容器Ⅲ
B.反應到達平衡時,PCl5的轉化率:容器Ⅱ>容器Ⅰ
C.反應到達平衡時,容器Ⅰ中的平均速率為v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始時向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,則反應將向逆反應方向進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某二元酸(化學式用H2X表示)在水中的電離方程式是:H2X=H++HX- HX-![]() H++X2-,常溫下,向10 mL 0.1000 mol/L的H2X溶液中逐滴加入0.1000 mol/L的NaOH溶液,pH隨NaOH溶液體積的變化如圖所示。下列敘述中正確的是
H++X2-,常溫下,向10 mL 0.1000 mol/L的H2X溶液中逐滴加入0.1000 mol/L的NaOH溶液,pH隨NaOH溶液體積的變化如圖所示。下列敘述中正確的是
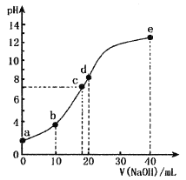
A.a點pH>1
B.b點溶液中:c(Na+)>c(HX-)>c(X2-)>c(H2X)>c(H+)>c(OH-)
C.d點溶液中:c(Na+)=2c(X2-)+2c(HX-)
D.水的電離程度:c>a>e
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵的許多化合物在生產、生活中有著廣泛的應用,如FeCl3是重要的金屬蝕刻劑、水處理劑;影視作品拍攝中常用Fe(SCN)3溶液模擬血液;FeS可用于消除水中重金屬污染等。
(1)已知:①3Cl2(g)+2Fe(s)=2FeCl3(s) ΔH1=akJ·mol-1
②2FeCl2(s)+Cl2(g)=2FeCl3(s) ΔH2=bkJ·mol-1
則2FeCl3(s)+Fe(s)=3FeCl2(s) ΔH3=____。
(2)將c(FeCl3)=0.2mol·L-1的溶液與c(KSCN)=0.5mol·L-1的溶液按等體積混合于某密閉容器發生反應:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,測得常溫下溶液中c(Fe3+)的濃度隨著時間的變化如圖1所示;測得不同溫度下t1時刻時溶液中c[Fe(SCN)3]如圖2所示。
Fe(SCN)3+3KCl,測得常溫下溶液中c(Fe3+)的濃度隨著時間的變化如圖1所示;測得不同溫度下t1時刻時溶液中c[Fe(SCN)3]如圖2所示。
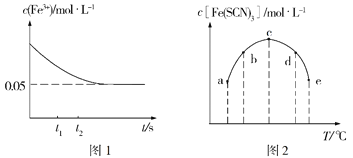
①研究表明,上述反應達到平衡后,向體系中加入適量KCl固體后,溶液顏色無變化,其原因是___,根據圖1分析,在t1、t2時刻,生成Fe3+的速率較大的是____時刻。
②常溫下Fe3++3SCN-![]() Fe(SCN)3的平衡常數的值約為___,其它條件不變時,若向容器中加適量蒸餾水,則新平衡建立過程中v(正)___v(逆)(填“>”“<”或“=”)。
Fe(SCN)3的平衡常數的值約為___,其它條件不變時,若向容器中加適量蒸餾水,則新平衡建立過程中v(正)___v(逆)(填“>”“<”或“=”)。
③根據圖2判斷,該反應的ΔH___0(填“>”或“<”),圖中五個點對應的狀態中,一定處于非平衡態的是___(填對應字母)。
(3)利用FeS可除去廢水中的重金屬離子,如用FeS將Pb2+轉化為PbS可消除Pb2+造成的污染,當轉化達到平衡狀態時,廢水中c(Fe2+)=___c(Pb2+)[填具體數據,已知Ksp(PbS)=8×10-28,Ksp(FeS)=6×10-18]。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:①Cl2+2KBr=2KCl+Br2;②KClO3+6HCl=3Cl2↑+KCl+3H2O;③2KBrO3+Cl2=Br2+2KClO3。下列說法正確的是:( )
A.①中KCl 是氧化產物,KBr發生還原反應
B.氧化性由強到弱的順序為KBrO3>KClO3>Cl2>Br2
C.反應②中氧化劑與還原劑的物質的量之比為1:6
D.③中1 mol氧化劑參加反應得到電子的物質的量為2.5 mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com