
【題目】過渡金屬元素在醫藥、催化劑、新材料等領域有著廣泛的應用。回答下列問題:
(1)下列有關說法正確的是_____。
A.銅元素焰色反應的光譜為吸收光譜
B.金屬鍵沒有方向性和飽和性
C.基態鐵原子核外未成對電子有4個
D.鋅屬于過渡元素,處于元素周期表的d區
(2)[Co(NH3)5Br](NO3)3是鉆元素形成的一種配位化合物。
①該配位化合物中心離子的價電子排布式為___,中心離子的配位數為____。
②該配位化合物中含氮離子的中心原子的雜化類型為______。
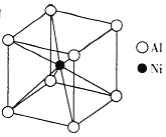
(3)①一種鋁鎳合金的結構如圖,與其結構相似的化合物是_____。
a.氯化鈉
b.氯化銫
c.石英
d.金剛石
②NiO、CoO的晶體結構均屬于NaC1型(Ni2+和Co2+的半徑分別為69pm和74pm),NiO的熔點比CoO高,其原因是____。
③已知CuO![]() Cu2O+O2↑(未配平),試從結構的角度解釋這一反應能夠發生的原因_____。
Cu2O+O2↑(未配平),試從結構的角度解釋這一反應能夠發生的原因_____。
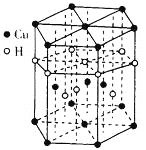
(4)Cu與H可形成一種紅色晶體,其晶胞結構如圖所示,則該化合物的化學式為____,一個晶胞的質量為_____g(NA為阿伏加德羅常數的值)。
【答案】BC 3d5 6 sp2 b NiO、CoO均為離子晶體,Ni2+、Co2+所帶電荷數相同,Ni2+比Co2+的半徑小,形成的離子鍵強,晶格能大 Cu+的3d能級有10個電子,處于較穩定的全充滿狀態,則Cu2+不如Cu+穩定 CuH ![]()
【解析】
(1)A.焰色反應為原子的發射光譜;
B.金屬鍵不是存在于相鄰原子之間的作用力,而是屬于整塊金屬,因此金屬鍵沒有方向性和飽和性;
C.根據基態鐵原子的價電子排布式為3d64s2判斷;
D.根據元素在周期表的分區作答;
(2)①根據化合價代數和為零,判斷鈷離子的電荷數,從而確定其價電子排布式;其中NH3、Br-均為中心離子的配體,配位數為6;
②該配位化合物中含氮離子為NO3-,計算價層電子對數,即可判斷中心原子的雜化類型;
(3)①根據“均攤法”確定鋁鎳合金的化學式,以及陰陽離子的配位數,再以此進行比較;
②離子晶體的晶格能越大,熔沸點越高;
③Cu+的3d能級有10個電子,處于較穩定的全充滿狀態,而Cu2+不如Cu+穩定;
(4)根據“均攤法”確定該晶體的化學式;再計算晶胞的質量。
(1)A.當金屬及其鹽在火焰上灼燒時,原子中的電子吸收了能量,從能量較低的軌道躍遷到能量較高的軌道,但處于能量較高軌道上的電子是不穩定的,很快躍遷回能量較低的軌道,這時就將多余的能量以光的形式放出,因此銅元素焰色反應的光譜為發射光譜,A項錯誤;
B.金屬鍵不是存在于相鄰原子之間的作用力,而是屬于整塊金屬,因此金屬鍵沒有方向性和飽和性,B項正確;
C.基態鐵原子的價電子排布式為3d64s2,在3d軌道上有4個未成對電子,C項正確;
D.鋅屬于過渡元素,處于元素周期表的ds區,D項錯誤;
故答案為:BC;
(2)①鈷離子的化合價為+4價,鈷離子核外有23個電子,其價電子排布式為3d5;
中心離子鈷離子的的配位數為6;
故答案為:3d5;6;
②該配位化合物中含氮離子為NO3-,孤電子對數為(5+1-3×2)/2=0,σ鍵電子對數為3,,價層電子對數為3+0=3,則中心原子的雜化類型為sp2;
故答案為:sp2;
(3)①由圖可知鋁鎳合金的晶胞結構中,Ni原子數目為1,Al原子數目為8×1/8
=1,其化學式為AlNi,每個Ni原子周圍有8個Al原子,每個Al原子周圍有8個Ni原子,a.氯化鈉中每個鈉離子周圍有6個氯離子,每個氯離子周圍有6個鈉離子,不符合;
b.氯化銫中每個銫離子周圍有8個氯離子,每個氯離子周圍有8個銫離子,符合;
c.石英為空間立體網狀結構,硅原子周圍有4個氧原子,氧原子周圍有2個硅原子,不符合;
d.金剛石為空間立體網狀結構,每C原子周圍有4個C原子,不符合;
故答案為:b;
②NiO、CoO均為離子晶體,Ni2+、Co2+所帶電荷數相同,Ni2+比Co2+的半徑小,形成的離子鍵強,晶格能大,則NiO的熔點比CoO高;
故答案為:NiO、CoO均為離子晶體,Ni2+、Co2+所帶電荷數相同,Ni2+比Co2+的半徑小,形成的離子鍵強,晶格能大;
③Cu+的3d能級有10個電子,處于較穩定的全充滿狀態,而Cu2+不如Cu+穩定;
故答案為:Cu+的3d能級有10個電子,處于較穩定的全充滿狀態;而Cu2+不如Cu+穩定;
(4)觀察晶胞結構知,12個頂點上(頂點上原子為6個晶胞共用)各有一個Cu、上下兩個面中心各有一個Cu、晶胞體內有3個Cu,則一個晶胞內Cu原子的個數為12×1/6+2×1/2+3=6;6個棱上(棱上原子為3個晶胞共用)各有一個H,體內有4個H,故一個晶胞內H原子的個數為6×1/3+4=6;則化學式為CuH,一個晶胞的質量為![]() ;
;
故答案為:CuH;![]() 。
。


 小學能力測試卷系列答案
小學能力測試卷系列答案科目:高中化學 來源: 題型:
【題目】指出下列化學反應類型(氧化、酯化、加成、取代)
(1)CH2Cl2+Br2![]() CHBrCl2+HBr _____________
CHBrCl2+HBr _____________
(2)CH2=CH2+Br2→CH2BrCH2Br __________
(3)![]() +HNO3
+HNO3![]()
![]() NO2 +H2O _______________
NO2 +H2O _______________
(4)![]() ___________
___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設 NA 為阿伏加德羅常數,下列敘述正確的是( )
A.含1mol乙酸的溶液中H+數等于0.1NA
B.標準狀況下,22.4L乙醇的分子數為NA
C.28g乙烯和丙烯所含碳氫鍵的數目為4NA
D.1 mol甲基所含的電子數為10NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是( )
A. 用銀氨溶液檢驗乙醛中的醛基:CH3CHO + 2Ag(NH3)2+ +2OH-![]() CH3COONH4 + 3NH3 + 2Ag↓+ H2O
CH3COONH4 + 3NH3 + 2Ag↓+ H2O
B. 苯酚鈉溶液中通入少量CO2:CO2+ H2O + 2C6H5O-→ 2C6H5OH + CO32-
C. 氯乙烷中滴入AgNO3溶液檢驗其中氯元素:Cl-+ Ag+ =AgCl↓
D. 硫酸鋁溶液中加入過量的氨水:Al3+ + 3NH3·H2O=Al(OH)3↓ + 3NH4+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹵代烴 R—CH2—CH2—X 中化學鍵如圖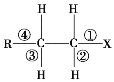 所示,則下列說法正確的是()
所示,則下列說法正確的是()
A. 發生水解反應時,被破壞的鍵是①和③
B. 發生消去反應時,被破壞的鍵是①和④
C. 發生水解反應時,被破壞的鍵是①
D. 發生消去反應時,被破壞的鍵是①和②
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖1是銅鋅原電池示意圖。圖2中,x軸表示實驗時流入正極的電子的物質的量,y軸表示( )

A. 銅棒的質量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素A、B、C、D、E、F的原子序數依次增大。A、E元素的原子最外層均只有一個電子,且A和E可形成離子化合物;B是組成有機化合物的核心元素;C的單質是空氣中含量最多的氣體;D原子的最外層電子數是其內層電子數的3倍;F和D同主族。請回答:
(1)A、D、E組成的化合物的電子式為_____。
(2)B元素在周期表中的位置是__,由它組成的一種同素異形體屬于原子晶體,其名稱為___。
(3)C、D的簡單氫化物中熱穩定性較強的物質的化學式為____。
(4)E、F的最高價氧化物對應的水化物之間反應的離子方程式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用電解法可提純含有某些含氧酸根雜質的粗KOH溶液,其工作原理如圖所示。下列有關說法錯誤的是
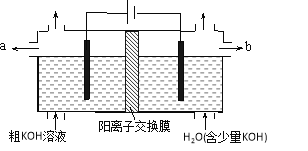
A. 通電后陰極區附近溶液pH會增大
B. 陽極反應式為4OH--4e-=2H2O+O2↑
C. 純凈的KOH溶液從b出口導出
D. K+通過交換膜從陰極區移向陽極區
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對滴有酚酞試液的下列溶液,操作后顏色變深的是
A. 明礬溶液加熱 B. CH3COONa溶液加熱
C. 氨水中加入少量NH4Cl固體 D. 小蘇打溶液中加入少量NaCl固體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com