
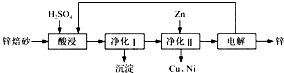
工業上利用鋅焙砂(主要含ZnO、ZnFe2O4,還含有少量CaO、FeO、CuO、NiO等氧化物)制取金屬鋅的流程如圖所示。回答下列問題:

(1)酸浸時ZnFe2O4會生成兩種鹽,該反應的化學方程式為___________。
(2)凈化Ⅰ操作分為兩步:第一步是將溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+轉化為Fe(OH)3沉淀。
①寫出酸性條件下H2O2與Fe2+反應的離子方程式:___________。
②25 ℃時,pH=3的溶液中,c(Fe3+)=________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③凈化Ⅰ生成的沉淀中還含有溶液中的懸浮雜質,溶液中的懸浮雜質被共同沉淀的原因是____________________。
(3)若沒有凈化Ⅱ操作,則對鋅的制備帶來的影響是_________________。
⑷本流程中可以循環利用的物質除鋅外還有________________。
(13分,第(1)小題3分,其余每空2分)
(1)ZnFe2O4+4H2SO4=ZnSO4+Fe2(SO4)3+4H2O
(2)①H2O2+2Fe2++2H+=2Fe3++2H2O;②4.0×10-5;③Fe(OH)3膠體(沉淀)具有吸附性;(3)制取的鋅含銅等雜質;(4)H2SO4、ZnSO4 (每空2分,共12分)
【解析】(1)根據信息,酸浸時ZnFe2O4會生成兩種鹽,這兩種鹽分別為硫酸鋅、硫酸鐵,即ZnFe2O4與硫酸反應生成硫酸鋅、硫酸鐵,反應的化學方程式為:ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3 +4H2O,
答案為:ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3 +4H2O;
(2)①亞鐵離子被雙氧水氧化成鐵離子,反應的離子方程式為H2O2+2Fe2++2H+═2Fe3++2H2O,答案為:H2O2+2Fe2++2H+═2Fe3++2H2O;
②氫氧化鐵的溶度積Ksp[Fe(OH)3
]=4.0×10-38,pH=3的溶液中,氫氧根離子的濃度為1×10-11mol·L-1,c(Fe3+)= mol·L-1=4.0×10-5mol·L-1,
mol·L-1=4.0×10-5mol·L-1,
答案為:4.0×10-5;
③由于生成的Fe(OH)3膠體(沉淀)具有吸附性,所以凈化Ⅰ生成的沉淀中還含有溶液中的懸浮雜質,答案為:Fe(OH)3膠體(沉淀)具有吸附性;
(3)由于鋅焙砂中含有CaO、FeO、CuO、NiO等氧化物,反應后溶液中存在銅離子,沒有凈化Ⅱ操作,電解制取的鋅中會含有銅等雜質,答案為:制取的鋅含銅等雜質;
(4)通過制取金屬鋅的流程圖示可以知道,可以循環利用的物質除鋅外,含有硫酸、硫酸鋅,
答案為:H2SO4、ZnSO4.
考點:制備實驗方案的設計


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源:2013-2014學年四川省涼山州高三第二次診斷性測試理綜化學試卷(解析版) 題型:填空題
工業上利用鋅焙砂(主要含ZnO、ZnFe2O4,還含有少量CaO、FeO、CuO、NiO等氧化物)制取金屬鋅的流程如圖所示。回答下列問題:
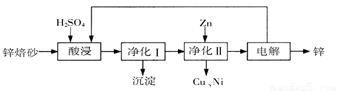
(1)酸浸時ZnFe2O4會生成兩種鹽,該反應的化學方程式為
(2)凈化I操作分為兩步:第一步是將溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+轉為Fe(OH)3沉淀。
①寫出酸性條件下H2O2與Fe2+反應的離子方程式
②250C時,pH=3的溶液中,c (Fe3+)=
mol/L(已知25℃,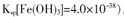 。
。
③凈化I生成的沉淀中還含有溶液中的懸浮雜質,溶液中的懸浮雜質被共同沉淀的原因是 。
(3)若沒有凈化II操作,則對鋅的制備帶來的影響是 。
(4)本流程中可以循環利用的物質除鋅外還有 。
查看答案和解析>>
科目:高中化學 來源:臨沂三模 題型:問答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com