
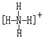
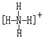


科目:高中化學 來源: 題型:閱讀理解
 已知A、B、C、D、E五種元素的原子序數依次遞增,A、B、C、D位于前三周期.A位于周期表的s區,其原子中電子層數和未成對電子數相同;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同;D原子的核外成對電子數是未成對電子數的3倍.A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,A、B二種元素組成的原子個數比為1:1的化合物N是常見的有機溶劑.E有“生物金屬”之稱,E4+離子和氬原子的核外電子排布相同.
已知A、B、C、D、E五種元素的原子序數依次遞增,A、B、C、D位于前三周期.A位于周期表的s區,其原子中電子層數和未成對電子數相同;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同;D原子的核外成對電子數是未成對電子數的3倍.A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,A、B二種元素組成的原子個數比為1:1的化合物N是常見的有機溶劑.E有“生物金屬”之稱,E4+離子和氬原子的核外電子排布相同.查看答案和解析>>
科目:高中化學 來源: 題型:
(1)D元素在周期表中的位置是_______________周期_____________族。?
(2)寫出兩種均含有A、B、C、D四種元素的化合物相互反應逸出氣體的離子方程式。
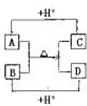
(3)用A元素的單質和B元素的單質可以制成電池,電池中裝有濃KOH溶液,用多孔的金屬惰性電極浸入KOH溶液中,兩極均有特制的氣體透過性隔膜,在一極通入A的單質,另一極通入B的單質,則通入A單質的一極的電極反應方程式是________________。
(4)A、C組成的化合物,常作為野外考察的取氫(H2)劑。試寫出該化合物的電子式_________;該化合物中加入適量的水,即可生成氫氣。經研究發現,該化合物若加入某些單質(如:Si、Al),再加水,則可以產生更多的氫氣。現取2 mol 該化合物,加入適量的單質硅再加入足量的水恰好反應,產生氫氣________________mol 。
查看答案和解析>>
科目:高中化學 來源:09~10年長春市十一高中高二下學期期末考試化學卷 題型:填空題
(10分)現有A、B、C、D四種短周期元素(零族除外),請根據信息回答下列問題。
| 元素 | A | B | C | D |
| 性質或結構信息 | 元素非金屬性較強,其最高價氧化物對應的水化物為強酸,但其單質穩定,常作保護氣。 | 原子核外電子占了4個軌道 | 原子半徑僅比氫原子大,其氫化物溶于水形成弱酸 | 原子核外有5種不同能量的電子,且s電子數比p電子數少1個 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年浙江省高三上學期第三次統練理綜化學試卷(解析版) 題型:填空題
A、B、C、D、E為五種常見的短周期元素,常溫下,A、B可形成B2A2和B2A兩種液態化合物,B與D可組成分子X,X水溶液呈堿性,C元素的焰色反應呈黃色,E與C同周期,且E的簡單離子半徑是同周期元素形成的簡單離子中半徑最小的。試回答:
(1)D元素在周期表中的位置為 。
(2)B2 A和X的分子結合質子 的能力不同,只用一個離子方程式就能證明,寫出該離子反應方程式 。
(3)A、D、E三種元素形成的鹽(化學式A9D3E)的水溶液呈酸性,用離子方程式解釋其原因 ;
(4)W、Q是由A、B、C、D四種元素中任意三種組成的不同類型的強電解質,常溫下0.1mol·L—1W的水溶液的pH為13,Q的水溶液呈酸性且能和W反應放出氣體,物質的量濃度相同的 W、Q溶液中水的電離程度是前者小于后者。則:W為 ,Q為 (填化學式)。
(5)B和E形成的化合物E2B6常在有機合成中作強還原劑,甚至可將二氧化碳重新還原成甲烷,寫出該反應方程式 。
(6)已知工業合成X的反應方程式:D2
(g)+3B2 (g)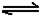 2X(g);△H
=-92.4 kJ·mol-1 ,在適當的催化劑和恒溫恒壓條件下反應,下列說法正確的有 。
2X(g);△H
=-92.4 kJ·mol-1 ,在適當的催化劑和恒溫恒壓條件下反應,下列說法正確的有 。
A.達到化學平衡時,正逆反應速率相等
B.反應過程中不斷分離出X,使平衡常數K減小,平衡正向移動有利于合成X
C.達到平衡后,升高溫度,平衡常數K增大,B2的轉化率降低
D.達到化學平衡的過程中,氣體平均相對分子質量減小
查看答案和解析>>
科目:高中化學 來源:09-10年長春市高二下學期期末考試化學卷 題型:填空題
(10分)現有A、B、C、D四種短周期元素(零族除外),請根據信息回答下列問題。
|
元素 |
A |
B |
C |
D |
|
性質或結構信息 |
元素非金屬性較強,其最高價氧化物對應的水化物為強酸,但其單質穩定,常作保護氣。 |
原子核外電子占了4個軌道 |
原子半徑僅比氫原子大,其氫化物溶于水形成弱酸 |
原子核外有5種不同能量的電子,且s電子數比p電子數少1個 |
(1)A元素原子的核外電子排布式為: 。
(2)寫出C元素的單質與水反應的化學方程式 ;A、C兩元素的氫化物的穩定性強弱是 > (用化學式表示)。
(3)D元素最高價氧化物對應的水化物呈 (選填“酸性”、“堿性”或“兩性”)。
(4)B元素最簡單的氫化物分子為 分子(選填“極性”或“非極性”)。4g該氫化物在空氣中完全燃燒生成液態水時,放出222.575kJ熱量,寫出表示該氫化物燃燒熱的熱化學方程式 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com