【答案】
分析:(1)化學平衡常數(shù)指一定溫度下,可能反應到達平衡是各生成物濃度冪之積與各反應物濃度冪之積的比值,據(jù)此書寫;
(2)由表中數(shù)據(jù)可知,溫度越高平衡常數(shù)越大,說明升高溫度平衡向正反應移動,據(jù)此判斷△H;
(3)當反應達到平衡狀態(tài)時,正逆反應速率相等,各物質(zhì)的濃度、百分含量不變,以及由此衍生的一些量也不發(fā)生變化,據(jù)此解答,解題時要注意,選擇判斷的物理量,隨著反應的進行發(fā)生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態(tài);
(4)某溫度下,平衡濃度符合下式:c(CO
2)?c(H
2)=c(CO)?c(H
2O),據(jù)此計算平衡常數(shù),進而判斷溫度;
(5)a.根據(jù)化石燃料燃燒產(chǎn)物是二氧化碳判斷;
b.根據(jù)綠色植物的光合作用能吸收大氣中的二氧化碳判斷;
c.根據(jù)采用節(jié)能技術能減少化石燃料的使用判斷;
d.根據(jù)利用太陽能、風能可以減少化石燃料的使用判斷;
(6)根據(jù)自然界中碳的途徑回答,自然界中碳氧循環(huán)主要涉及光合作用和呼吸作用,最合理的是自然循環(huán)過程.原子利用率最高的是應是化合反應,所有原子都可進入產(chǎn)品.
解答:解:(1)化學平衡常數(shù)指一定溫度下,可能反應到達平衡是各生成物濃度冪之積與各反應物濃度冪之積的比值,CO
2(g)+H
2(g)?CO(g)+H
2O(g)的平衡常數(shù)k=

,故答案為:

;
(2)由表中數(shù)據(jù)可知,溫度越高平衡常數(shù)越大,說明升高溫度平衡向正反應移動,升高溫度平衡向吸熱反應移動,故正反應為吸熱反應,故答案為:吸熱;
(3)a.反應前后氣體的物質(zhì)的量不變,溫度一定,容器中壓強始終不變,故壓強不變,不能說明到達平衡狀態(tài),故a錯誤;
b.反應達到平衡狀態(tài)時,各物質(zhì)的濃度不變,混合氣體中c(CO)不變,說明到達平衡狀態(tài),故b正確;
c.v (H
2)
正=v (H
2O)
逆不同物質(zhì)表示的速率之比等于化學計量數(shù)之比,說明到達平衡狀態(tài),故c正確;
d.平衡時二氧化碳與一氧化碳的濃度與轉(zhuǎn)化率有關,c(CO
2)=c(CO)不能說明到達平衡,故d錯誤;
故答案為;bc;
(4)某溫度下,平衡濃度符合下式:c(CO
2)?c(H
2)=c(CO)?c(H
2O),則CO
2(g)+H
2(g)?CO(g)+H
2O(g)的平衡常數(shù)k=
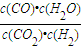
=1,故為830℃,故答案為:830;
(5)a.化石燃料燃燒產(chǎn)物是二氧化碳,減少化石燃料的使用就減少了二氧化碳的排放,故a正確;
b.綠色植物通過光合作用能吸收大氣中的二氧化碳,同時釋放氧氣,植樹造林,增大植被面積可增強植物的光合作用,降低空氣中二氧化碳的含量,故b正確;
c.采用節(jié)能技術能減少化石燃料的使用,減少化石燃料的使用就減少了二氧化碳的排放,故c正確;
d.利用太陽能、風能能減少化石燃料的使用,化石燃料燃燒產(chǎn)物是二氧化碳,減少化石燃料的使用就減少了二氧化碳的排放,故d正確;
故答案為:abcd;
(6)光合作用是自然界中碳循環(huán)的反應,不需要再人為提供能源,所以a最節(jié)能;C是化合反應,所有原子都變成了產(chǎn)物,所以利用率最高,故答案為:a,c.
點評:題目綜合性較大,考查化學平衡常數(shù)及影響因素、平衡移動、平衡狀態(tài)的判斷等,難度中等,注意平衡狀態(tài)的判斷,選擇的物理量,隨著反應的進行發(fā)生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態(tài).

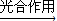 C6H12O6+6O2 b.CO2+3H2
C6H12O6+6O2 b.CO2+3H2 CH3OH+H2O
CH3OH+H2O CH3COOH d.2CO2+6H2
CH3COOH d.2CO2+6H2 CH2=CH2+4H2O
CH2=CH2+4H2O ,故答案為:
,故答案為: ;
;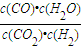 =1,故為830℃,故答案為:830;
=1,故為830℃,故答案為:830;

 期末寶典單元檢測分類復習卷系列答案
期末寶典單元檢測分類復習卷系列答案 在一定體積的密閉容器中,進行如下化學反應:CO2(g)+H2(g)?CO(g)+H2O(g).其化學平衡常數(shù)K和溫度T的關系如下表,回答下列問題:
在一定體積的密閉容器中,進行如下化學反應:CO2(g)+H2(g)?CO(g)+H2O(g).其化學平衡常數(shù)K和溫度T的關系如下表,回答下列問題: