
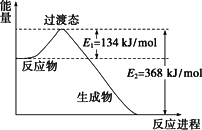
下圖是NO2和CO反應生成CO2和NO過程中能量變化示意圖,請寫出NO2和CO反應的熱化學方程式:________.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:閱讀理解

| ||
| (一定條件) |

查看答案和解析>>
科目:高中化學 來源:廣東省惠州一中、深圳高級中學2011-2012學年高一下學期期末聯(lián)考化學試題 題型:022
(1)20世紀30年代,Eyring和Pelzer在碰撞理論的基礎上提出化學反應的過渡態(tài)理論:化學反應并不是通過簡單的碰撞就能完成的,而是在反應物到生成物的過程中經(jīng)過一個高能量過渡態(tài).下圖是NO2和CO反應生成CO2和NO過程中能量變化示意圖,請寫出NO2和CO反應的熱化學方程式:________.

(2)紅磷P(s)和Cl2(g)發(fā)生反應生成PCl3(g)和PCl5(g).反應過程和能量關系如圖所示(圖中的?H表示生成1 mol產(chǎn)物的數(shù)據(jù)).根據(jù)上圖回答下列問題:

①P和Cl2反應生成PCl3的熱化學方程式________;
②PCl5分解成PCl3和Cl2的熱化學方程式是________;
(3)科學家利用太陽能分解水生成氫氣,再用氫氣與二氧化碳在催化劑作用下反應生成甲醇,并開發(fā)出直接以甲醇(CH3OH)為燃料的燃料電池.已知:
CO(g)+1/2O2(g)=CO2(g); ΔH=-283.0 kJ·mol-1;
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1.
請回答下列問題:
液態(tài)甲醇不完全燃燒生成一氧化碳氣體和液態(tài)水的熱化學方程式為________
(4)已知稀溶液中,H2SO4與1 mol NaOH溶液恰好完全反應時,放出57.3 kJ熱量,寫出表示H2SO4與NaOH反應的熱化學方程式________.
(5)25℃、101 kPa條件下充分燃燒一定量的甲烷氣體生成CO2氣體和液態(tài)水,放出熱量為Q kJ,經(jīng)測定,將生成的CO2通入足量澄清石灰水中產(chǎn)生25 g白色沉淀,寫出甲烷燃燒的熱化學方程式________.
(6)通常人們把拆開1 mol某化學鍵所吸收的能量看成該化學鍵的鍵能.鍵能的大小可用于估算化學反應的反應熱(ΔH),化學反應的ΔH等于反應中斷裂舊化學鍵的鍵能之和與反應中形成新化學鍵的鍵能之和的差.
![]()
寫出常溫常壓下氫氣與氯氣反應的熱化學方程式________;
該反應中氫氣與氯氣的總能量________(填“大于”、“等于”、“小于”)氯化氫的總能量.
查看答案和解析>>
科目:高中化學 來源:2013-2014學年廣東省肇慶市高三上學期期末質量檢測理綜化學試卷(解析版) 題型:填空題
化工行業(yè)的發(fā)展必須符合國家節(jié)能減排的總體要求。請回答下列問題:
(1)已知C(s)+H2O(g) CO(g)+H2(g),則該反應的平衡常數(shù)表達式為 。
CO(g)+H2(g),則該反應的平衡常數(shù)表達式為 。
(2)已知在一定溫度下,
C(s)+CO2(g)
 2CO(g)
△H1
2CO(g)
△H1
CO(g)+H2O(g)
 H2(g)+CO2(g)
△H2
H2(g)+CO2(g)
△H2
C(s)+H2O(g) CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
則△H1、△H2、△H3之間的關系是: 。
(3)通過研究不同溫度下平衡常數(shù)可以解決某些實際問題。已知等體積的一氧化碳和水蒸氣進入反應時,會發(fā)生如下反應: CO(g)+H2O(g)  H2(g)+CO2(g),該反應平衡常數(shù)隨溫度的變化如表所示。
H2(g)+CO2(g),該反應平衡常數(shù)隨溫度的變化如表所示。
|
溫度/℃ |
400 |
500 |
800 |
|
平衡常數(shù)K |
9.94 |
9 |
1 |
則該反應的正反應方向是 反應(填“吸熱”或“放熱”),在500℃時,若設起始時CO和H2O的起始濃度均為0.020mol/L,則CO的平衡轉化率為 。
(4)從氨催化氧化可以制硝酸,此過程中涉及氮氧化物,如NO、NO2、N2O4等。對反應N2O4(g)  2NO2(g)
△H>0在溫度為T1、T2時,平衡體系中NO2的體積分數(shù)隨壓強變化曲線如圖所示。下列說法正確的是 :
2NO2(g)
△H>0在溫度為T1、T2時,平衡體系中NO2的體積分數(shù)隨壓強變化曲線如圖所示。下列說法正確的是 :

A.A、C兩點的反應速率:A>C
B.A、C兩點氣體的顏色:A深,C淺
C.B、C兩點的氣體的平均相對分子質量:B<C
D.由狀態(tài)A到狀態(tài)B,可以用加熱的方法
E.A、C兩點的化學平衡常數(shù):A=C
(5)工業(yè)上用Na2SO3吸收尾氣中的SO2,再用下圖裝置電解(惰性電極)NaHSO3制取H2SO4(陰離子交換膜只永許陰離子通過),陽極電極反應式為: ,陽極區(qū)逸出氣體的成分為 (填化學式)。

查看答案和解析>>
科目:高中化學 來源: 題型:
氮是地球上含有豐富的一種元素,氮及其化合物在公農(nóng)業(yè)生產(chǎn)、生活中有著重
要作用,減少N的氧化物在大氣中的排放是環(huán)境保護的重要內容之一。
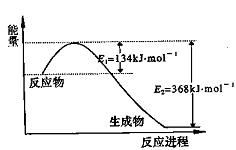
(1)上圖是1 mol NO2和1 mol CO反應生成CO2和NO過程中能量變化示意圖,請寫出
NO2和CO反應的熱化學方程式: ;
又知:N2 (g)+2NO2 (g)=4NO(g) △H=+292.3kJ?mol―1,則反應:
2NO(g)+2CO(g) ![]() N2(g)+2CO2 (g)的△H為 ;
N2(g)+2CO2 (g)的△H為 ;
(2)一定溫度下,在2L密閉容器中NO2和O2可發(fā)生下列反應:
4NO2 (g)+O2 (g) ![]() 2N2O5(g);已知體系中n(NO2)隨時間變化如下表:
2N2O5(g);已知體系中n(NO2)隨時間變化如下表:
t(s) | 0 | 500 | 1000 | 1500 |
n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
① 寫出該反應的平衡常數(shù)表達式:K= ,已知:![]() ,則該反
,則該反
應是 熱反應;
② 反應達到平衡后,NO2的轉化率為 ,此時若再通入一定量氮氣,則NO2
的轉化率將 (填“增大”、“減小”、“不變”);
③ 下圖中表示N2O5的濃度的變化曲線是 ,
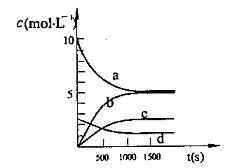
用O2表示從0~500s內該反應的平均速率v= 。
查看答案和解析>>
科目:高中化學 來源:2011年四川省德陽市廣漢中學高考化學練習試卷(解析版) 題型:填空題

 2NH3,
2NH3,
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com