
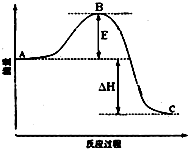
 安徽金和上市公司近期新增硫酸生產線.其主要反應 為:2SO2(g)+O2(g)═2SO3(g),該反應過程的能量變化如圖所示.
安徽金和上市公司近期新增硫酸生產線.其主要反應 為:2SO2(g)+O2(g)═2SO3(g),該反應過程的能量變化如圖所示.分析 (1)反應物總能量大于生成物總能量,為放熱反應,加入催化劑,活化能減小,反應反應熱不變,根據反應2SO2(g)+O2(g)=2SO3(g)結合1mol SO2(g)氧化為1mol SO3的△H=-99kJ•mol-1計算反應熱;
(2)平衡常數K=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$;
(3)根據化學平衡狀態的特征解答,當反應達到平衡狀態時,正逆反應速率相等,各物質的濃度、百分含量不變,以及由此衍生的一些量也不發生變化,解題時要注意,選擇判斷的物理量,隨著反應的進行發生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態;
(4)有利于提高SO2平衡轉化率,說明平衡向著正向移動,根據各選項條件對化學平衡的影響進行判斷.
解答 解:(1)因圖中A、C分別表示反應物總能量、生成物總能量,E為活化能,反應熱可表示為A、C活化能的大小之差,活化能的大小與反應熱無關,加入催化劑,因為催化劑改變了反應的歷程使活化能E降低,但不能改變反應物的總能量和生成物的總能量之差,不改變反應熱,因1mol SO2(g)氧化為1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化為2molSO3的△H=-198kJ•mol-1,則2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,
故答案為:無;不變;-198;
(2)2SO2(g)+O2(g)=2SO3(g),反應的平衡常數K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$,故答案為:$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$;
(3)A.可逆反應到達平衡時SO2和SO3濃度不一定相等,與二氧化硫的起始濃度以及轉化率有關,故A錯誤;
B.SO2百分含量保持不變,說明二氧化硫的濃度不變,反應達到平衡狀態,故B正確;
C.隨反應進行氣體的物質的量減小,恒溫恒容下,容器內氣體壓強減小,當容器中氣體的壓強不變,說明到達平衡狀態,故C正確;
D.SO3的生成速率與SO2的消耗速率都表示正反應速率,反應始終二者都按1:1進行,不能說明到達平衡狀態,故D錯誤;
E.密閉容器中體積恒定,質量守恒,所以混合氣體的密度始終不變,不能判斷平衡狀態,故E錯誤.
故答案為:BC;
(4)A、升高溫度,平衡向著逆向移動,二氧化硫的轉化率減小,故A錯誤;
B、降低溫度,平衡向著正向移動,二氧化硫的轉化率增大,故B正確;
C、增大壓強,增大壓強,平衡向著正向移動,二氧化硫的轉化率增大,故C正確;
D、減小壓強,減小壓強,平衡向著逆向移動,二氧化硫的轉化率減小,故D錯誤;
E、加入催化劑,催化劑不影響化學平衡,二氧化硫的轉化率不變,故E錯誤;
G、移出氧氣,反應物濃度減小,平衡向著逆向移動,二氧化硫的轉化率減小,故G錯誤;
故答案為:BC.
點評 本題綜合考查反應熱與焓變、化學平衡標志、平衡常影響因素等知識點,為高考常見題型,側重于學生的分析能力和計算能力的考查,注意催化劑對反應的影響以及反應熱計算的應用,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 過濾、結晶、灼燒、萃取、分液和蒸餾等都是常用的分離有機混合物的方法 | |
| B. | 洗滌膠頭滴管時,只要在水龍頭的流水中,滴頭朝上,膠頭朝下不斷擠壓膠頭即可 | |
| C. | 通常采用產生氣泡的快慢,來比較不同條件下Na2S2O3溶液與稀硫酸的反應速率 | |
| D. | 吸入氯氣、氯化氫氣體時,可吸入少量酒精或乙醚的混合蒸氣解毒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,22gCO2氣體中所含分子數大于0.5NA | |
| B. | 1LCO2和1LCO所含分子數相同 | |
| C. | 等質量的O2和O3,所含的原子數一定相等 | |
| D. | 1mol•L-1的NaOH溶液中Na+數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 恒溫恒壓下,若混合氣體密度不變,說明反應已達平衡 | |
| B. | 恒容時通入氬氣,壓強不變,正逆反應速率也不變 | |
| C. | 降低溫度可以縮短反應達到平衡的時間 | |
| D. | 恒容時通入X2,平衡向正反應方向移動,平衡常數不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿性氧化物均為金屬氧化物 | |
| B. | 一種元素可能有多種氧化物,但是同種化合價只對應一種氧化物 | |
| C. | 酸根離子中不可能含有金屬元素 | |
| D. | 還原產物只有還原性,氧化產物只有氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1828年德國化學家維勒首次在實驗室里合成了尿素 | |
| B. | 19世紀初,瑞典化學家貝采利烏斯首次使用“有機”一詞,并提出了“有機化學”和“有機化合物”的概念 | |
| C. | 1965年我國科學家人工合成了具有生物活性的蛋白質--結晶牛胰島素 | |
| D. | 1830年,德國化學家李比希創立了有機化合物的定量分析方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
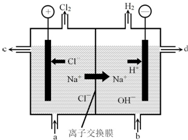 氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品.
氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | V=4.48 L | B. | V=5.6 L | C. | 4.48 L<V<5.6 L | D. | V<4.48 L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com