
【題目】下列說法中,正確的是( )
①![]() 與
與![]() 是不同的核素,因此分別由這兩種原子構成的
是不同的核素,因此分別由這兩種原子構成的![]() 2與
2與![]() 2化學性質不同
2化學性質不同
②![]() 2、
2、![]() 2、
2、![]() 2互為同位素,
2互為同位素,![]()
③C60與12C、14C互為同位素
④科學家已發現了H3分子,H2與H3互為同素異形體
⑤稀土元素![]() 與
與![]() 的質量數不同,屬于兩種元素
的質量數不同,屬于兩種元素
⑥H2O與D2O互稱同素異形體
⑦![]() 和
和![]() 質子數相同,互為同位素
質子數相同,互為同位素
A. ④⑥ B. ③⑦ C. ②⑤ D. ④⑦
【答案】D
【解析】元素是質子數相同的一類原子的統稱,核素就是一種原子,同位素簡單說就是同種元素的不同原子,同素異形體是由同種元素形成的性質不同的單質;其中同位素之間、同素異形體之間的物理性質不同,化學性質幾乎相同。
①![]() 與
與![]() 是不同的核素,也是O元素的兩種同位素,由它們形成的單質
是不同的核素,也是O元素的兩種同位素,由它們形成的單質![]() 2和
2和![]() 2的物理性質不同,但化學性質幾乎相同,所以①錯誤;
2的物理性質不同,但化學性質幾乎相同,所以①錯誤;
②![]() 2、
2、![]() 2、
2、![]() 2是由H的三種同位素
2是由H的三種同位素![]() 形成的單質,故②錯誤;
形成的單質,故②錯誤;
③C60是由C元素形成的單質,而12C、14C是C元素的兩種同位素,所以③錯誤;
④H2與H3都是由H元素形成的單質,它們互為同素異形體,則④正確;
⑤稀土元素![]() 與
與![]() 的質量數不同,但質子數相同,所以它們是同一種元素,則⑤錯誤;
的質量數不同,但質子數相同,所以它們是同一種元素,則⑤錯誤;
⑥H2O與D2O是由H的兩種同位素與O形成的化合物,不是同素異形體,故⑥錯誤;
⑦![]() 和
和![]() 質子數相同,則為同一種元素,但質量數不同,即中子數不同,所以互為同位素,故⑦正確。可見只有④⑦是正確的。本題答案為D。
質子數相同,則為同一種元素,但質量數不同,即中子數不同,所以互為同位素,故⑦正確。可見只有④⑦是正確的。本題答案為D。


科目:高中化學 來源: 題型:
【題目】每年3月22日是“世界水日”,聯合國確定2016年“世界水日”的宣傳主題是““水與就業”。下列關于水的敘述不正確的是 ( )
A.生化反應必須在水中進行
B.水是細胞鮮重中含量最多的化合物
C.水在細胞中的存在形式并非一成不變
D.自由水與結合水的比例與新陳代謝的強弱關系不大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的一部分,請參照元素①—⑨在表中的位置,回答下列問題。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)第三周期中元素非金屬性最強的元素的原子結構示意圖是_____________。
(2)②③⑦最高價氧化物對應水化物酸性由強到弱的順序是_________(填化學式)。
(3)用電子式表示⑨的氫化物的形成過程:_________________________。
(4)下列可以判斷⑤和⑥金屬性強弱的是________________(填序號)。
a. 單質的熔點⑤比⑥低 b. 化合價⑤比⑥低
c. 單質與水反應⑤比⑥劇烈 d. 最高價氧化物的水化物的堿性⑤比⑥強
(5)為驗證ⅦA族部分元素非金屬性的遞變規律,設計下圖裝置進行實驗,請回答:
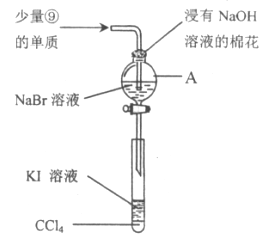
①儀器A的名稱是_____________,A中發生的反應的離子方程式是_________。
②棉花中浸有的NaOH溶液的作用是(用離子方程式表示)_____________________。
③為驗證溴與碘非金屬性強弱:通入少量⑨的單質,充分反應后,將A中液體滴入試管內,取下試管,充分振蕩、靜置,可觀察到____________________。該實驗必須控制加入的⑨單質的量,否則得不出溴的非金屬性比碘強。理由是_____________________。
④ⅦA族元素,非金屬性隨元素核電荷數增加而逐漸減弱的原因:同主族元素從上到下原子半徑逐漸______________(填“增大”或“減小”),得電子能力逐漸減弱。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活、社會發展息息相關,下列有關說法不正確的是( )
A. 在元素周期表的金屬和非金屬分界線附近尋找半導體材料
B. 漂白粉失效是由于漂白粉中的Ca(ClO)2與空氣中的CO2反應生成的HClO見光分解
C. 少量液溴要保存在棕色細口瓶中,并在液溴上面加水封
D. 向煤中加入適量CaCO3,可大大減少燃燒產物中溫室氣體的排放
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是氯堿工業的主要產品之一,常作強氧化劑,可與有機物和無機物進行反應生成多種氯化物。某興趣小組在實驗室中對以下反應進行了探究。回答下列問題:
Ⅰ、三氯化硼(BCl3)的制備,

查閱資料:已知:①BCl3的沸點為12.5 ℃,熔點為-107.3 ℃; ②2B+6HCl ![]() 2BCl3↑+3H2↑;
2BCl3↑+3H2↑;
③BCl3遇水觀察到大量的白霧。
(1)檢驗發生裝置A的氣密性的實驗具體方法是_____________________________________
(2)按氣流方向連接各裝置的接口,順序為_______
a→( )→( )→( )→( )→( )→( )→ ( ) → ( ) →h。
(3)裝置D的作用是________________;裝置E的作用是___________________________,實驗中若不用裝置C,可能產生的后果是____________。
(4)BCl3遇水反應的化學方程式為:_____________________________。
Ⅱ、SO2與漂粉精溶液的反應
操作 | 現象 |
取4g 漂粉精固體,加入100mL 水,測漂粉精溶液的pH | pH 試紙先變藍(約為12),后褪色 |
| 1.液面上方出現白霧; 2.稍后,出現渾濁,溶液變為黃綠色; 3.稍后,產生大量白色沉淀,黃綠色褪去 |
(5)pH試紙顏色的變化說明漂粉精溶液具有的性質是_____________________________。
(6)現象2中溶液變為黃綠色的原因是:隨溶液酸性的增強,漂粉精的有效成分和Cl- 發生反應。該反應的離子方程式為________________________。
(7)用離子方程式解釋現象3中黃綠色褪去的原因_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某含錳礦物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3難溶于水。一種運用陰離子膜電解法的新技術可用于從碳酸錳礦中提取金屬錳,主要物質轉化關系如下:

(1)設備1中反應后,濾液1里錳元素只以Mn2+的形式存在,且濾渣1中也無MnO2。濾渣1的主要成分是 (填化學式)。
(2)設備1中發生氧化還原反應的離子方程式是 。
(3)設備2中加足量雙氧水的作用是 。設計實驗方案檢驗濾液2中是否存在Fe2+: 。
(4)設備4中加入過量氫氧化鈉溶液,沉淀部分溶解,。用化學平衡移動原理解釋原因: 。
(5)設備3中用陰離子膜法提取金屬錳的電解裝置圖如下:

① 電解裝置中箭頭表示溶液中陰離子移動的方向,則A電極是直流電源的 極。實際生產中,陽極以稀硫酸為電解液,陽極的電極反應式為 。
② 該工藝之所以采用陰離子交換膜,是為了防止Mn2+進入陽極區發生副反應生成MnO2造成資源浪費,寫出該副反應的電極反應式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏伽德羅常數,下列敘述正確的是( )
①NaHSO4晶體中陽離子和陰離子的數目比為1:1
②22.4LCH4與18gH2O所含有的電子數均為10NA
③1molSiO2晶體中含NA個SiO2分子
④標準狀況下,2.24LCCl4含有的共價鍵數為0.4NA
⑤20gD2O和18gH2O中含有的質子數均為10NA
⑥在K35ClO3+6H37Cl===KCl+3Cl2↑+3H2O中,若生成71gCl2,則轉移的電子數目為![]() NA
NA
⑦在含1mol硅原子的二氧化硅晶體中含有4NA個Si—O鍵
A. ①②③④⑤⑦ B. ①⑤⑥⑦ C. ①⑤⑦ D. ④⑤⑥⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗和現象,所得實驗結論正確的是( )
選項 | 實驗 | 現象 | 實驗結論 |
A | 向某溶液中先滴加適量稀硝酸,再滴加少量BaCl2溶液 | 出現白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一種或幾種 |
B | 向裝有Fe(NO3)2溶液的試管中加入稀硫酸 | 在管口觀察到紅棕色氣體 | HNO3分解成了NO2 |
C |
| 左邊棉球變為橙色,右邊棉球變為藍色 | 氧化性:Cl2>Br2>I2 |
D | SO2和SO3混合氣體通入Ba(NO3)2溶液 | 出現白色沉淀 | 得到的沉淀只有BaSO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向含有H2SO4的H2O2溶液中滴加一定量的KMnO4溶液,反應開始后,溶液中Mn2+的濃度c將隨時間t的變化而變化。某學生在做實驗前認為,Mn2+的濃度c與時間t的關系如圖甲所示,做完實驗后,得到的結果如圖乙所示。請回答下列問題:
(1)寫出H2O2與KMnO4反應的化學方程式 。
(2)Oa段的意義為 。
(3)ab段的意義及ab段陡的原因為 。
(4)bc段的意義為。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com