
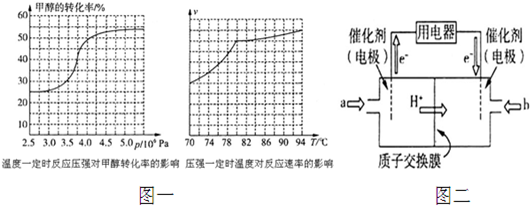
 如圖裝置中,容器甲內充入0.1mol NO氣體.干燥管內裝有一定量Na2O2,從A處緩慢通入CO2氣體.恒溫下,容器甲中活塞緩慢由D處向左移動,當移至C處時容器體積縮至最小,為原體積的$\frac{9}{10}$,干燥管中物質的質量增加了2.24g.隨著CO2的繼續通入,活塞又逐漸向右移動.下列說法中正確的是( )
如圖裝置中,容器甲內充入0.1mol NO氣體.干燥管內裝有一定量Na2O2,從A處緩慢通入CO2氣體.恒溫下,容器甲中活塞緩慢由D處向左移動,當移至C處時容器體積縮至最小,為原體積的$\frac{9}{10}$,干燥管中物質的質量增加了2.24g.隨著CO2的繼續通入,活塞又逐漸向右移動.下列說法中正確的是( )| A. | 活塞從D處移動到C處的過程中,通入的CO2氣體為2.24 L (標準狀況) | |
| B. | NO2轉化為N2O4的轉化率為20% | |
| C. | 容器甲中NO已反應完 | |
| D. | 活塞移至C處后,繼續通入a mol CO2,此時活塞恰好回至D處,則a小于0.01 |
分析 A.干燥管內質量增重,由于發生反應2Na2O2+2CO2=2Na2CO3+O2,利用差量法計算參加反應的二氧化碳的體積;
B.容器甲中發生反應2NO+O2=2NO2,2NO2?N2O4,根據①計算生成氧氣的體積,進而計算n(O2),根據過量計算,判斷氧氣與NO反應生成的二氧化氮的物質的量,此過程容器甲的體積不變,此后由于發生反應2NO2?N2O4,甲容器的體積減小,根據體積變化,判斷混合氣體物質的量減少量,根據差量法計算參加反應的二氧化氮的物質的量,再根據轉化率定義計算;
C.根據B的計算判斷NO是否完全反應;
D.活塞移至C,體積不會再減少,則干燥管中Na2O2已反應完,活塞由C向D移動,體積擴大,2NO2?N2O4平衡左移,使二者物質的量增多,活塞移至D時,氣體物質的量共增加0.01 mol,因此所需CO2必小于0.01 mol.
解答 解:A.設通入標準狀況下CO2氣體的體積為x,產生氧氣的體積為y,則:
2Na2O2+2CO2=2Na2CO3+O2 質量裝置△m
2×22.4 L 22.4 L 56 g
x y 2.24 g
所以56 g:2.24g=2×22.4 L:x,解得x=1.792L,
56 g:2.24g=22.4 L:y,解得:y=0.896L,即:通入二氧化碳的體積為1.792L,故A錯誤;
B.由A計算可知,生成氧氣的物質的量:n(O2)=$\frac{0.896L}{22.4L/mol}$=0.04mol,
2NO+O2 =2NO2
2 1 2
0.08mol 0.04 mol 0.08 mol
0.1 mol>0.08 mol,所以NO過量,生成NO2的物質的量為0.08 mol,
所以2NO2?N2O4 物質的量減少△n
2 1 1
0.02 mol 0.1 mol×(1-$\frac{9}{10}$)=0.01mol
所以NO2轉化為N2O4的轉化率為:$\frac{0.02mol}{0.08mol}$×100%=25%,故B錯誤;
C.根據B的計算可知,NO還剩余:0.1mol-0.08mol=0.02mol,故C錯誤;
D.活塞移至C,體積不會再減少,則干燥管中Na2O2已反應完,活塞由C向D移動,體積擴大,2NO2?N2O4平衡左移,使二者物質的量增多,活塞移至D時,氣體物質的量共增加0.01 mol,因此所需CO2必小于0.01 mol,故D正確;
故選D.
點評 本題考查了混合物反應的計算,側重考查NO、CO2和過氧化鈉反應的有關計算與判斷,試題綜合性強,過程復雜,計算量很大,難度很大,為易錯題目,該題是高考中的常見考點和題型,旨在考查學生靈活運用基礎知識解決實際問題的能力,有利于培養學生的邏輯推理能力和發散思維能力,側重對學生能力的培養和解題方法的指導與訓練.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
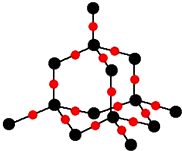 現代世界產量最高的金屬是Fe、Al、Cu.
現代世界產量最高的金屬是Fe、Al、Cu. )分子中碳原子雜化類型為SP2,分子中σ鍵比π鍵多5個.
)分子中碳原子雜化類型為SP2,分子中σ鍵比π鍵多5個.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
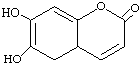
| A. | M的相對分子質量是178 | |
| B. | M有機物中含有2種官能團 | |
| C. | M與足量的NaOH溶液發生反應時,所得有機產物的化學式為C9H9O5Na | |
| D. | 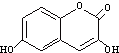 與M互為同分異構體 與M互為同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
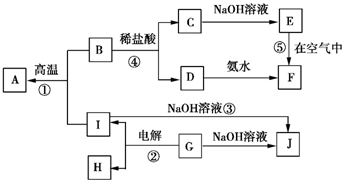 A~I分別表示中學化學中常見的一種物質,它們之間的相互關系如圖所示(部分反應物、生成物沒有列出),且A、B、C、D、E、F六種物質中均含同一種元素.
A~I分別表示中學化學中常見的一種物質,它們之間的相互關系如圖所示(部分反應物、生成物沒有列出),且A、B、C、D、E、F六種物質中均含同一種元素.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 溫度 | 時間/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n( N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n( N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | 10min內,T1時的v(N2)比T2時的小 | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2時,若向平衡后的容器中再充入1.2molCH4,重新達到平衡時n(N2)=0.40mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
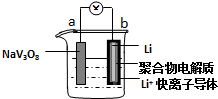
| A. | 放電時,該電池的總反應為:xLi+NaV3O8═NaLixV3O8 | |
| B. | 充電過程中Li+從陽極向陰極遷移 | |
| C. | 充電過程中陽極的電極反應式為NaLixV3O8-xe-═NaV3O8+xLi+,NaLixV3O8中釩的化合價發生變化 | |
| D. | 該電池可以用硫酸鈉溶液作電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗室里熔化氫氧化鈉時,可選用石英坩堝和鐵坩堝 | |
| B. | 不法商家制取的“地溝油”具有固定的熔沸點 | |
| C. | 食品保鮮膜按材質可分為聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等,PVC的單體可由PE的單體與氯化氫加成制得 | |
| D. | 家庭用食用醋代替CO2來增強漂白粉的漂白性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
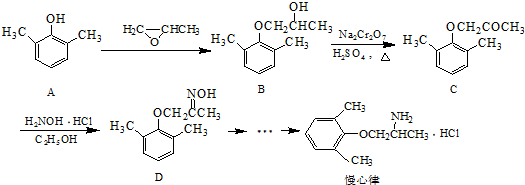
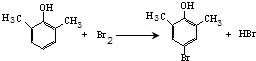 .
. .
. .
. .
.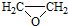 ).寫出以鄰甲基苯酚 (
).寫出以鄰甲基苯酚 (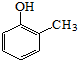 )和乙醇為原料制備
)和乙醇為原料制備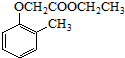 的合成路線流程圖(無機試劑任用).
的合成路線流程圖(無機試劑任用).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com