
【題目】甲醇(CH3OH)熱值高、無污染,既可做燃料,又是重要的化工原料。科學家正研究利用CO2生產甲醇以發展低碳經濟。
(1)已知CO(g)和CH3OH(l)的燃燒熱分別為283kJmol-1和726kJmol-1。則甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式為______。
(2)根據甲醇在酸性電解質溶液中與氧氣作用生成二氧化碳和水的反應,設計一種燃料電池,則其負極反應式為______。若該燃料電池消耗1mol甲醇所能產生的最大電能為689.7kJ,與其燃燒所能釋放的全部能量相比,該燃料電池的理論效率為______。
(3)探究不同條件下對合成甲醇反應的影響:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
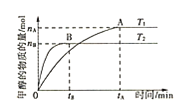
①其他條件不變,T1、T2兩種溫度下CH3OH的物質的量隨時間的變化如圖,則該反應在T1時的平衡常數比T2時的______(填“大”、“小”),處于A點的反應體系從T1變到T2,達到平衡時 ______(填“增大”、“減小”或“不變”)。
______(填“增大”、“減小”或“不變”)。
②某溫度下,在體積為1L的密閉容器中加入4molCO2、8molH2,測得H2的物質的量隨時間變化如圖曲線(甲)所示:

則a→b時間段內v(CH3OH)=______molL-1min-1;若僅改變某一條件再進行實驗,測得H2的物質的量隨時間變化如圖中虛線(乙)所示。曲線(乙)對應改變的實驗條件可以是______(填序號)。
A.加催化劑 B.增大壓強 C.升高溫度 D.增大CO2濃度
若圖中曲線甲平衡后保持恒溫恒容,按如表各組的物質的量再次增加投入反應混合物,其中平衡向正反應方向進行的是______。
物質 | n(CO2) | n(H2) | n(CH3OH) | n(H2O) |
A | 0 | 0 | 1 | 1 |
B | 1 | 0 | 1 | 0 |
C | 0 | 1 | 1 | 0 |
【答案】CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-443kJmol-1 CH3OH-6e-+H2O=CO2+6H+ 95% 大 增大 0.5 BD C
【解析】
(1)根據CO(g)和CH3OH(l)的燃燒熱,寫出熱化學方程式,再根據蓋斯定律分析解答;
(2)燃料電池中,通入燃料的電極做負極,則負極為甲醇放電生成CO2,據此書寫電極反應式;燃料電池的理論效率=![]() ×100%;
×100%;
(3)①根據圖象,結合平衡移動原理進行分析;②由圖可知:a→b時間段內,△n(H2)=3mol,△t=2min,據此計算v(H2)=,v(CH3OH)=![]() v(H2);根據影響化學平衡的因素分析判斷;先根據三段式求出平衡常數K,再根據Qc與K比較判斷平衡移動的方向。
v(H2);根據影響化學平衡的因素分析判斷;先根據三段式求出平衡常數K,再根據Qc與K比較判斷平衡移動的方向。
(1)CO(g)的燃燒熱的熱化學方程式為:①CO(g)+![]() O2(g)=CO2(g) △H=-283kJmol-1;CH3OH(l)的燃燒熱的熱化學方程式為:②CH3OH(l)+
O2(g)=CO2(g) △H=-283kJmol-1;CH3OH(l)的燃燒熱的熱化學方程式為:②CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-726kJmol-1,根據蓋斯定律:反應②-反應①即可得甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-726kJmol-1+283kJmol-1 = -443kJmol-1,故答案為:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-443kJmol-1;
O2(g)=CO2(g)+2H2O(l) △H=-726kJmol-1,根據蓋斯定律:反應②-反應①即可得甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-726kJmol-1+283kJmol-1 = -443kJmol-1,故答案為:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-443kJmol-1;
(2)對于燃料電池,燃料做負極,則負極為甲醇放電生成CO2,根據電子轉移、電荷守恒,電極反應式為:CH3OH-6e-+H2O=CO2+6H+;該燃料電池的理論效率=![]() ×100%=95%,故答案為:CH3OH-6e-+H2O=CO2+6H+;95%;
×100%=95%,故答案為:CH3OH-6e-+H2O=CO2+6H+;95%;
(3)①由圖可知,T1溫度下,平衡時甲醇的物質的量更多,所以T1時的平衡常數比T2時的大;T2溫度下反應先達平衡,則T2>T1,且甲醇的物質的量減少,說明平衡逆移,正反應為放熱反應,處于A點的反應體系從T1變到T2,相當于升高溫度,平衡逆移,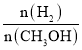 增大,故答案為:大;增大;
增大,故答案為:大;增大;
②由圖可知:a→b時間段內,△n(H2)=3mol,△t=2min,則v(H2)=![]() =
=![]() =
=![]() =1.5mol/(Lmin),v(CH3OH)=
=1.5mol/(Lmin),v(CH3OH)=![]() v(H2)=0.5mol/(Lmin);A、加入催化劑,平衡不移動, H2平衡的物質的量不變,故A錯誤;B、增大壓強,反應速率加快,平衡正移,H2的物質的量減小,符合圖象變化,故B正確;C、升高溫度,反應速率加快,平衡逆移,H2的物質的量增大,不符合圖象變化,故C錯誤;D、增大CO2濃度,反應速率加快,平衡正移,H2的物質的量減小,符合圖象變化,故D正確;故選BD;
v(H2)=0.5mol/(Lmin);A、加入催化劑,平衡不移動, H2平衡的物質的量不變,故A錯誤;B、增大壓強,反應速率加快,平衡正移,H2的物質的量減小,符合圖象變化,故B正確;C、升高溫度,反應速率加快,平衡逆移,H2的物質的量增大,不符合圖象變化,故C錯誤;D、增大CO2濃度,反應速率加快,平衡正移,H2的物質的量減小,符合圖象變化,故D正確;故選BD;
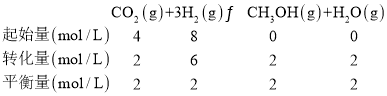
平衡常數K=![]() =
=![]() =0.25(mol/L)-2,A、只加生成物,則平衡逆移,故A錯誤;B、Qc=
=0.25(mol/L)-2,A、只加生成物,則平衡逆移,故A錯誤;B、Qc=![]() =0.25=K,平衡不移動,故B錯誤;C、Qc=
=0.25=K,平衡不移動,故B錯誤;C、Qc=![]() =0.11<K,平衡正移,故C正確;故選C,故答案為:0.5;BD;C。
=0.11<K,平衡正移,故C正確;故選C,故答案為:0.5;BD;C。


科目:高中化學 來源: 題型:
【題目】某同學欲利用如圖裝置制取能較長時間存在的Fe(OH)2,其中實驗所用溶液現配現用且蒸餾水先加熱煮沸。下列分析正確的是
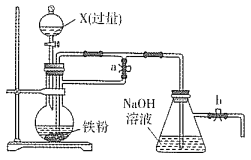
A. X可以是稀硫酸或稀硝酸或稀鹽酸
B. 實驗開始時應先關閉止水夾a、打開b,再向燒瓶中加入X
C. 反應一段時間后可在燒瓶中觀察到白色沉淀
D. 反應結束后若關閉b及分液漏斗活塞,則Fe(OH)2可較長時間存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在電解冶煉鋁的過程中加入冰晶石(Na3AlF6)可起到降低Al2O3熔點的作用。
(1)基態氟原子中,電子占據的最高能層的符號為______,電子占據最高能級上的電子數為______。
(2)向NaAlO2及氟化鈉溶液中通入CO2,可制得冰晶石。
①該反應中涉及的非金屬元素的電負性由大到小的順序為______________。
②1molCO2中含有的σ鍵數目為________,其中C原子的雜化方式為_________;CO2與SCNˉ互為等電子體,SCNˉ的電子式為_________。
③Na2O的熔點比NaF的高,其理由是:_________。
(3)冰晶石由兩種微粒構成,冰晶石的晶胞結構如圖所示,●位于大立方體的頂點和面心,○位于大立方體的12條棱的中點和8個小立方體的體心,那么大立方體的體心處△所代表的微粒是________(填微粒符號)。
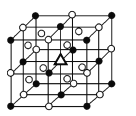
(4)冰晶石稀溶液中存在的化學鍵有________(填標號)。
A 離子鍵 B 共價鍵 C 配位鍵 D 氫鍵
(5)金屬鋁晶體中的原子堆積方式為面心立方最密堆積,其晶胞參數為apm,則鋁原子的半徑為______pm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學模擬工業制碘的方法,探究ClO3-和I-的反應規律。實驗操作及現象如下:
實驗及試劑 | 編號 | 無色NaClO3溶液用量 | 試管中溶液顏色 | 淀粉KI試紙顏色 |
| 1 | 0.05mL | 淺黃色 | 無色 |
2 | 0.20mL | 深黃色 | 無色 | |
3 | 0.25mL | 淺黃色 | 藍色 | |
4 | 0.30mL | 無色 | 藍色 |
(1)取實驗2后的溶液,進行如下實驗:
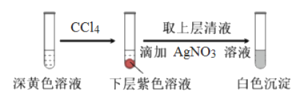
經檢驗,上述白色沉淀是AgCl。寫出加入0.20mLNaClO3后,溶液中ClO3-和I-發生反應的離子方程式____________。
(2)查閱資料:一定條件下,I-和I2都可以被氧化成IO3-。
作出假設:NaClO3溶液用量增加導致溶液褪色的原因是過量的NaClO3溶液與(1)中的反應產物繼續反應,同時生成Cl2,反應的離子方程式是______________________。
進行實驗:取少量實驗4中的無色溶液進行以下實驗,進一步佐證其中含有IO3-。其中試劑X可以是_________(填字母序號)。
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
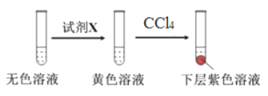
獲得結論:NaClO3溶液用量增加導致溶液褪色。
(3)小組同學繼續實驗,通過改變實驗4中硫酸溶液的用量,獲得如下實驗結果:
編號 | 6.0mol·L-1H2SO4溶液用量 | 試管中溶液顏色 | 淀粉KI試紙顏色 |
5 | 0.25mL | 淺黃色 | 無色 |
6 | 0.85mL | 無色 | 藍色 |
①對比實驗4和5,可以獲得的結論是______________________。
②實驗6中ClO3-和I-反應的離子方程式是______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】連二亞硫酸鈉(Na2S2O4)俗稱保險粉,是一種淡黃色粉末,易溶于水,不溶于乙醇。在實驗室制備連二亞硫酸鈉流程如下:
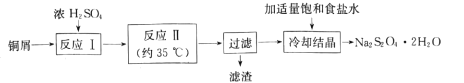
(1)反應Ⅰ是制備SO2,下圖裝置可制取純凈干燥的SO2:
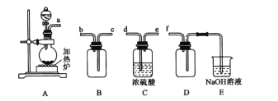
①按氣流方向連接各儀器接口,順序為a→ ___→f,裝置D的作用是______。
②裝置A中反應的化學方程式為___。
(2)反應Ⅱ所用實驗裝置如圖所示(部分裝置省略)。
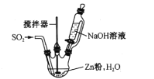
①通SO2之前先強力攪拌,將鋅粉和水制成懸濁液,其目的是_________;控制反應溫度的方法是____
②反應Ⅱ的離子方程式為 ___。
(3)“濾渣”經洗滌、灼燒,可得到一種工業產品是____(填化學式);加入適量飽和食鹽水的目的是 ___。
(4)產品Na2S2O42H2O久置空氣中易被氧化,其氧化產物可能是_______(寫2種)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在“宏觀——微觀——符號”之間建立聯系是化學學科特有的思維方式。如圖是科研人員提出的HCHO與O2在羥基磷灰石(HAP)表面催化氧化生成CO2、H2O的歷程示意圖(圖中只畫出了HAP的部分結構)。下列說法不正確的是
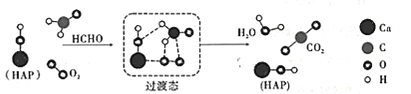
A.HAP能降低HCHO與O2反應的活化能
B.該反應的化學方程式為HCHO+O2![]() CO2+H2O
CO2+H2O
C.反應過程中斷裂或生成的的化學鍵類型均為極性共價鍵
D.產物CO2分子中的氧原子不僅僅來源于O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質的表達式正確的是
A. 乙炔分子的比例模型示意圖:![]()
B. 2-甲基-2-戊烯的鍵線式:![]()
C. ![]() 的名稱:3-甲基-1-丁烯
的名稱:3-甲基-1-丁烯
D. 1,3-丁二烯的分子式:C4H8
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上將石灰石和硫煤混合使用,稱之為“固硫”,其反應原理為:2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
已知:CaO(s)+CO2(g)![]() CaCO3(s) △H2=bkJ·mol-1;
CaCO3(s) △H2=bkJ·mol-1;
2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
請回答下列問題:
(1)CaSO4(s)![]() CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
(2)T1℃時,向某恒容密閉容器中通入一定量的CO2和足量CaO發生反應:CaO(s)+CO2(g)![]() CaCO3(s),CO2的濃度隨時間變化如圖所示:
CaCO3(s),CO2的濃度隨時間變化如圖所示:
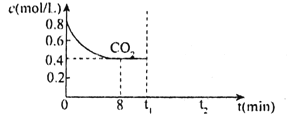
①0~8min,v(CO2)=___。
②t1min時,若保持其他條件不變,壓縮容器體積至原來的![]() ,t2min重新達到平衡,請在圖中畫出CO2的濃度自條件改變至新平衡的變化曲線___。
,t2min重新達到平衡,請在圖中畫出CO2的濃度自條件改變至新平衡的變化曲線___。
(3)T2℃時,向某密閉容器中通入2molSO2和1molO2發生反應:2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
①若該容器為恒壓密閉容器,下列選項可判斷反應已達平衡狀態的是___。
A.混合氣體的密度不再改變
B混合氣體的壓強不再改變
C.相同時間內,每斷裂0.1molO=O鍵,同時生成0.2molSO3
D.混合氣體的平均相對分子質量不再改變
②若該容器為2L的恒容密閉容器,達平衡時SO3的體積分數為40%,則O2的轉化率為___,T2℃時該反應的平衡常數K=___。
③反應達到②中的平衡狀態后,保持反應溫度和O2的濃度不變,增大容器體積,則平衡將___(填“正向”、“逆向”或“不“)移動,原因為___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com