
鐵及其化合物在生活、生產中有著廣泛的應用。
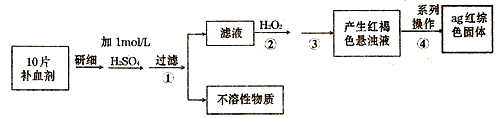
Ⅰ.鐵觸媒(+2價鐵和+3價鐵組成的氧化物)是工業合成氨的催化劑。某學習小組用下列流程測定鐵觸媒的含鐵量。根據題意回答相關問題:
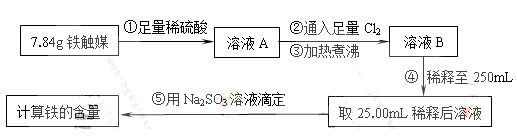
(1)步驟①中需用1.50 mol·L-1的硫酸100mL,若用18.4mol·L-1的濃硫酸來配制,則需要用量筒量取濃硫酸 mL
(2)步驟②通入Cl2的目的是 (用離子方程式表示)
(3)步驟④后需用 (填儀器名稱)取25.00mL稀釋后溶液。
(4)步驟⑤消耗0.10mol·L-1的Na2SO3溶液25.00mL,則鐵觸媒中鐵的質量分數為 。
Ⅱ.目前的研究表明,鐵的某些含氧酸鹽可用于工業廢水、廢氣的處理。
(1)用K2FeO4處理中性廢水時與水反應生成氫氧化鐵膠體,并放出無色無味的氣體和其它物質,寫出反應的離子反應方程式 ,處理廢水時既利用K2FeO4強氧化性,又利用生成氫氧化鐵膠體的 作用。
(2)MFe2O4可以與氫氣反應制備新型納米材料氧缺位鐵酸鹽MFe2Ox (3<x<4),其中M表示+2價的金屬元素,常溫下,MFe2Ox能使工業廢氣中的SO2轉化為S,達到回收硫、凈化空氣目的,轉化過程表示如下:
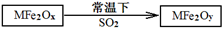
則可以判斷x y,氧化性:MFe2Oy SO2(填“>”、“<”或“=”)
Ⅰ.(1)8.2(2)2Fe2++Cl2=2Fe3++2Cl-(3)酸式滴定管(或移液管) (4)35.7%
Ⅱ.(1)4FeO42-+ 10H2O = 4Fe(OH)3(膠體) +8OH- + 3O2↑;聚沉(或吸附)(2)<;<.
【解析】
試題分析:Ⅰ.在溶液稀釋前后溶質的物質的量不變,利用稀釋公式C1V1=C1V2可得1.50 mol·L-1×100m=18.4mol·L-1×Vml,解得V=8.2ml. (2)步驟②通入Cl2的目的是把亞鐵離子氧化為鐵離子,離子方程式是2Fe2++Cl2=2Fe3++2Cl-(3)氯化鐵溶液顯酸性要用移液管或酸式滴定管來量取,防止腐蝕堿式滴定管的橡膠管。(4)2Fe3++SO32-+H2O=2Fe2+SO42-+2H+可利用鐵離子與亞硫酸根離子的關系求解得到原來的固體中含有鐵的總物質的量為0.05mol,質量為0.05mol×6g/mol=2.8g.所以在鐵觸媒中鐵的質量分數為2.8g/7.84g×100℅=35.7%.Ⅱ.K2FeO4有強的氧化性,能殺菌、消毒,它本身被還原為鐵離子,鐵離子在溶液中水解產生氫氧化鐵膠體,氫氧化鐵膠體吸附水中的懸浮物使之變為沉淀,從而達到凈化水的目的。K2FeO4處理中性廢水時與水反應的離子方程式為:4FeO42-+ 10H2O = 4Fe(OH)3(膠體) +8OH- + 3O2↑
考點:考查鐵及其化合物在生活、生產中的應用及溶液稀釋問題等的知識。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
 鐵及其化合物在生活、生產中有廣泛應用.請回答下列問題:
鐵及其化合物在生活、生產中有廣泛應用.請回答下列問題:
| ||


查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 (2010?臨沂一模)Fe元素是地殼中最豐富的元素之一,在金屬中僅次于鋁,鐵及其化合物在生活、生產中有廣泛應用.請回答下列問題:
(2010?臨沂一模)Fe元素是地殼中最豐富的元素之一,在金屬中僅次于鋁,鐵及其化合物在生活、生產中有廣泛應用.請回答下列問題:
| ||


查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 催化劑 |
| 高溫高壓 |
| ||
查看答案和解析>>
科目:高中化學 來源:2012屆福建省泉州四校高三第二次聯考化學試卷 題型:填空題
(12分)鐵及其化合物在生活、生產中有廣泛應用。請回答下列問題:
(1)黃鐵礦(FeS2)是生產硫酸和冶煉鋼鐵的重要原料。其中一個反應為
3FeS2+8O2  6SO2+Fe3O4,有3 molFeS2參加反應,轉移 mol電子。
6SO2+Fe3O4,有3 molFeS2參加反應,轉移 mol電子。
(2)氯化鐵溶液常用作印刷電路銅板腐蝕劑,反應的離子方程式為 ;從腐蝕廢液回收得到金屬銅,還需要的試劑是 。
(3)與明礬相似,硫酸鐵也可用作凈水劑,在使用時發現硫酸鐵并不能使酸性廢水中的懸浮物沉降除去,其原因是
(4)鋼鐵的電化腐蝕簡單示意圖如下,將該圖稍作修改即可成為鋼鐵電化學防護的簡單示意圖,請在下圖虛線框內作出修改,并用箭頭標出電子流動方向。
查看答案和解析>>
科目:高中化學 來源:2010年沙河一中考前預測卷化學試題 題型:填空題
(12分)鐵及其化合物在生活、生產中有廣泛應用。請回答下列問題:
(1)黃鐵礦(FeS2)是生產硫酸和冶煉鋼鐵的重要原料。其中一個反應為
3FeS2+8O2 6SO2+Fe3O4,氧化產物為 ,若有3 mol FeS2參加反應,轉移
mol電子。
6SO2+Fe3O4,氧化產物為 ,若有3 mol FeS2參加反應,轉移
mol電子。
(2)氯化鐵溶液常用作印刷電路銅板腐蝕劑,反應的離子方程式為
。
(3)與明礬相似,硫酸鐵也可用作凈水劑,其原理為 (用離子方程表示)
(4)①鋼鐵的電化腐蝕簡單示意圖如下,將該圖稍作修改 即可成為鋼鐵電化學防護的簡單示意圖,請在下圖虛線框內作出修改,并用箭頭標出電子流動方向。

②寫出修改前的鋼鐵吸氧腐蝕石墨電極的電極反應式 。
(5)鐵紅是一種紅色顏料,其成分是Fe2O.3將一定量的鐵紅溶于160ml5 mol·L—1鹽酸中,在加入一定量鐵粉恰好溶解,收集到2.24L(標準狀況),經檢測,溶夜中無Fe3+,則參加反應的鐵粉的質量為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com